Работа зерновозам, перевозка зерна — объявления грузоперевозки в России и других странах
Сегодня 08:20ч.
Продаю Грузоперевозки
Оказываем услуги по перевозке сельхозпродукции и других видов груза, на любые расстояния. Разные виды машин (КамаЗ) , различной грузоподъемностью от 20 до 26 тонн.
Алтайский край
24 мая 2021г.
Продаю Грузоперевозки
Вывоз мусора в Ангарске Вывоз мебели ненужной Строительного мусора дачного ванн и батарей гаражного хлама Без выходных и праздников
Иркутская область
19 мая 2021г. 16:05ч.
Продаю Грузоперевозки
Доставим Диз. топливо от 300 со скидкой от производителя. Заправляем там, где удобно вам. Спец. технику по месту производства работ, грузовой и пассажирский транспорт и т.д.
Расчёт как наличный, так и безнал с НДС.
Максимальная скидка для постоя…
топливо от 300 со скидкой от производителя. Заправляем там, где удобно вам. Спец. технику по месту производства работ, грузовой и пассажирский транспорт и т.д.
Расчёт как наличный, так и безнал с НДС.
Максимальная скидка для постоя…
Новосибирская область
17 мая 2021г. 16:09ч.
Продаю Грузоперевозки
Грузоперевозки по городу Ангарск и Межгород — Переезды — Грузчики — Вывоз мусора — Перевозка стройматериалов — Пианино, оборудование — Вывоз мебели на городской полигон — Утилизации батарей Без выходных и праздников
Иркутская область
6 мая 2021г. 11:25ч.
11:25ч.
Куплю Грузоперевозки
На постоянную работу требуются зерновозы 10-20-25т. Погрузка в Иваново, выгрузка Ярославская обл., Московская обл., Ярославская обл.
Ивановская область
6 мая 2021г. 11:22ч.
Куплю Грузоперевозки
На постоянную работу требуются зерновозы 10-20-25т. Погрузка в Санкт-Петербурге, область
Погрузка в Санкт-Петербурге, область
Санкт-Петербург и область
6 мая 2021г. 11:20ч.
Куплю Грузоперевозки
На постоянную работу требуются зерновозы 10-20-25т. Погрузка в Туле, выгрузка в Тульской, Московская обл.
Тульская область
6 мая 2021г. 11:12ч.
11:12ч.
Куплю Грузоперевозки
На постоянную работу требуются зерновозы 10-20-25т. Погрузка в Ярославле, выгрузка в Ярославский р-н, Московская обл.
Ярославская область
5 мая 2021г. 15:01ч.
Профессионально перевезём Ваш скот (КРС, МРС, лошадей, свиней, баранов) на собственных скотовозах 16,5 метров!
Заключаем долгосрочные договоры с приоритетным предоставлением транспорта. Форма оплаты:
— наличный;
— безналичный без НДС;
— без…
Форма оплаты:
— наличный;
— безналичный без НДС;
— без…
Республика Татарстан
6 апреля 2021г. 16:11ч.
Продаю Грузоперевозки
Компания ООО «Артель» готова организовать для вас доставку груза автомобильным транспортом по России. Автоперевозки осуществляются на максимально выгодных условиях для наших клиентов. Для того, чтоб оформить заявку, нужно: позвонить менеджеру: …
Пермский край
1 марта 2021г. 17:54ч.
17:54ч.
Продаю Грузоперевозки
Осуществляем услуги на перевозку нефтепроуктов (ГСМ), по Амурской области и другим регионам.
Амурская область
2 февраля 2021г. 22:25ч.
Продаю Грузоперевозки
Оказываем услуги по перевозке сельхозпродукции и других видов груза. КАМАЗ 65116 с Турецким прицепом(зерновоз, боковал, на пневмо-пудушках, задний распашной борт, 3х – осный, объем 45 куб.м., грузоподъемность 28т).
КАМАЗ 65116 с Турецким прицепом(зерновоз, боковал, на пневмо-пудушках, задний распашной борт, 3х – осный, объем 45 куб.м., грузоподъемность 28т).
Алтайский край
2 февраля 2021г. 10:40ч.
Продаю Грузоперевозки
Аренда полуприцепа. Аренда тентованного полуприцепа. Тент 20 тонн. Грузоперевозки. Услуги автоперевозок. Перевозка груз.
Перевожу:
— Перевозка тарного и бестарного груза
— Перевозка конструкций (металлоконструкции, ЖБИ)
— Перевозка продуктов п.
Алтайский край
28 января 2021г. 02:48ч.
Продаю Грузоперевозки
CAR-GO! Транспортно-экспедиционная компания предлагает клиентам полный спектр логистических услуг, работая успешно на рынке более 15 лет. 1. Оперативная доставка сборных грузов по России от 1 кг до 20-тонн с ежедневной отправкой в г.Казань из г.М…
Республика Татарстан
18 декабря 2020г. 22:17ч.
22:17ч.
Продаю Грузоперевозки
Транспортная компания «Карго-БиЭлДжи» ваш надежный партнер в области перевозки негабаритных грузов для вашей компании с 2009 года. Перевозим грузы по всей России. Страхуем от «ВСЕХ РИСКОВ» Главным направлением компании служат перевозка негабаритны…
Амурская область
18 декабря 2020г. 22:16ч.
Продаю Грузоперевозки
Транспортная компания «Карго-БиЭлДжи» ваш надежный партнер в области перевозки негабаритных грузов для вашей компании с 2009 года. Перевозим грузы по всей России. Страхуем от «ВСЕХ РИСКОВ» Главным направлением компании служат перевозка негабаритны…
Перевозим грузы по всей России. Страхуем от «ВСЕХ РИСКОВ» Главным направлением компании служат перевозка негабаритны…
Краснодарский край
17 декабря 2020г. 15:59ч.
Продаю Грузоперевозки
Аренда трала. Негабаритный груз. Грузоперевозки. Услуги трала низкорамного. Крупногабаритный груз.
Мы перевозим:
— Перевозка негабаритного груза
— Перевозка конструкций (металлоконструкции, ЖБИ)
— Перевозка экскаваторов (Caterpillar, Komatsu,. ..
..
Алтайский край
16 декабря 2020г. 14:54ч.
Продаю Грузоперевозки
Аренда трала. Негабаритный груз. Грузоперевозки. Услуги трала низкорамного. Крупногабаритный груз. Мы перевозим: — Перевозка негабаритного груза — Перевозка конструкций (металлоконструкции, ЖБИ) — Перевозка экскаваторов (Caterpillar, Komatsu,…
Кемеровская область
16 декабря 2020г. 14:52ч.
14:52ч.
Продаю Грузоперевозки
Аренда трала. Негабаритный груз. Грузоперевозки. Услуги трала низкорамного. Крупногабаритный груз. Мы перевозим: — Перевозка негабаритного груза — Перевозка конструкций (металлоконструкции, ЖБИ) — Перевозка экскаваторов (Caterpillar, Komatsu,…
Новосибирская область
23 ноября 2020г. 15:17ч.
Продаю Грузоперевозки
Оказываем услуги бензовоза и термоса 30000л
доставка ДТ, с НДС.
Алтайский край
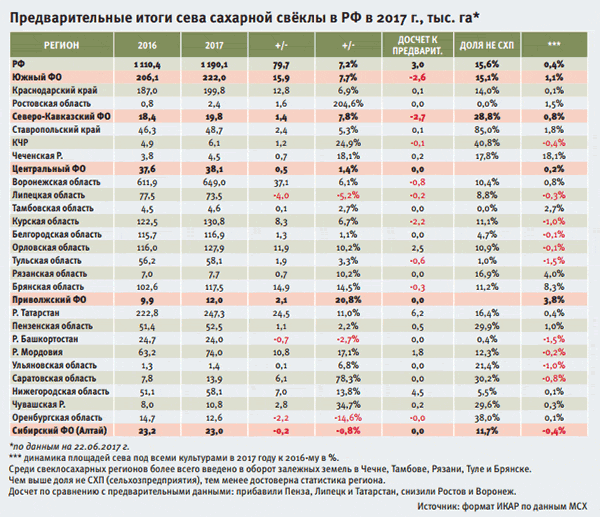
Железнодорожные перевозки сахара в РФ за ноябрь 2015 года
Таблица 1. Железнодорожные перевозки в РФ за 01.11.2015 по 30.11.2015 с ретроспективой, тыс. МТ
| Дата | 01.08.2015 — 31.08.2015 | 01.09.2015 — 30.09.2015 | 01.10.2015 — 31.10.2015 | 01.11.2015 — 30.11.2015 | Изменение за период, % | Доля в общих перевозках, % |
| внутрирегиональные | 12,07 | 37,43 | 44,78 | 61,33 | +36,96 ⇑ | 22,48 |
| межрегиональные | 118,44 | 170,68 | 184,92 | 179,56 | -2,90 ⇓ | 65,83 |
| экспортные | 0,13 | 1,56 | 1,19 | 0,14 | -88,63 ⇓ | 0,05 |
| импортные | 11,87 | 12,62 | 30,47 | 27,40 | -10,08 ⇓ | 10,04 |
| транзитные все | 26,78 | 11,35 | 8,68 | 4,35 | -49,92 ⇓ | 1,59 |
За рассматриваемый период внутреннее движение по территории РФ составило 240,89 тыс. МТ (включает все внутрирегиональные и межрегиональные отгрузки).
МТ (включает все внутрирегиональные и межрегиональные отгрузки).
Доля внутренних перевозок по российской территории составила 88,3%, доля экспортных 0,0%, импортных 10,0%, и транзитных 1,6%.
Соотношение внутрирегиональных к межрегиональных перевозкам составило 34,2%, за прошлый период 24,2%.
Объем внутрироссийских перевозок составил к прошлому периоду 104,9%.
Таблица 2. Межрегиональный баланс перевозок по макрорегионам РФ за 01.11.2015 — 30.11.2015, тыс. МТ
| Регион | Отгрузки внутри округа | Отгрузки из округа | Отгрузки в округ | Экспорт округа | Импорт округа | Сальдо округа за 01.11-30.11 |
| Центральный ФО | 36,36 | 127,57 | 1,42 | 0,00 | 12,96 | -76,83 ⇓ |
| Дальневосточный ФО | 2,31 | 0,54 | 5,01 | 0,00 | 0,00 | +6,77 ⇑ |
| Приволжский ФО | 13,62 | 35,36 | 36,03 | 0,00 | 5,44 | +19,73 ⇑ |
| Северо-Западный ФО | 0,00 | 0,00 | 21,15 | 0,00 | 6,41 | +27,56 ⇑ |
| Сибирский ФО | 6,46 | 0,20 | 66,61 | 0,00 | 1,21 | +74,08 ⇑ |
| Уральский ФО | 0,00 | 0,00 | 47,73 | 0,00 | 1,25 | +48,98 ⇑ |
| Южный ФО | 2,58 | 15,87 | 1,60 | 0,14 | 0,13 | -11,69 ⇓ |
Максимальные отгрузки внутри и из региона за указанный период произвел Центральный ФО. Отгрузки составили 163,94 тыс.МТ (68,1% от всех отгрузок внутри и из регионов).
Отгрузки составили 163,94 тыс.МТ (68,1% от всех отгрузок внутри и из регионов).
Экспорт произвел только Южный ФО в количестве 0,14 тыс.МТ (100,0% от всего экспорта).
Таблица 3. Импорт за 01.11.2015 — 30.11.2015, МТ
| Импорт из | за отчетный период, МТ | с начала года по 30.11.2015, МТ | за тот же период с начала прошлого года, МТ |
| Белоруссия | 27398 | 225090 | 238225 |
| Литва | 0 | 11260 | 9774 |
| Польша | 0 | 3808 | 1058 |
| Молдова | 0 | 0 | 48068 |
| Всего | 27398 | 240159 | 297125 |
Лидером по экспорту в Россию с начала года является Белоруссия: 225091 МТ, что на 59172 МТ больше сахара, чем в прошлом году за аналогичный период.
Объем поставок с начала года составил 240160 МТ, что на 24531 МТ больше чем за аналогичный период в прошлом году.
Таблица 4. Экспорт за 01.11.2015 — 30.11.2015, МТ
| Экспорт в | за отчетный период, МТ | с начала года по 30.11.2015, МТ | за тот же период с начала прошлого года, МТ |
| Казахстан | 0 | 4443 | 17500 |
| Киргизия | 0 | 2462 | 1874 |
| Грузия/Абхазия | 135 | 524 | 1114 |
| Туркменистан | 0 | 474 | 0 |
| Таджикистан | 0 | 387 | 6 |
| Монголия | 0 | 253 | 0 |
| Узбекистан | 0 | 0 | 446 |
| Молдова | 0 | 0 | 5876 |
| Всего | 135 | 8546 | 26817 |
Лидером по экспорту сахара из России с начала года является Казахстан: 4443 МТ, что на 13057 МТ меньше сахара, чем в прошлом году за аналогичный период.
С начала года общий экспорт сахара составил 8546 МТ, что на 18272 МТ меньше чем за аналогичный период в прошлом году.
Таблица 5. Транзит за 01.11.2015 — 30.11.2015, МТ
| Транзит в | за отчетный период, МТ | с начала года по 30.11.2015, МТ | за тот же период с начала прошлого года, МТ |
| Казахстан | 3547 | 183818 | 186945 |
| Киргизия | 53 | 65035 | 52872 |
| Таджикистан | 510 | 10368 | 9439 |
| Грузия/Абхазия | 127 | 4398 | 3928 |
| Туркменистан | 0 | 4375 | 0 |
| Узбекистан | 0 | 1087 | 9013 |
| Монголия | 110 | 110 | 170 |
| Украина | 0 | 40 | 0 |
| Всего | 4349 | 269233 | 262370 |
Лидирующий импортер сахара через Россию за период с начала года — Казахстан: 183819 МТ, что на 3126. 92 МТ меньше сахара, чем в прошлом году за аналогичный период.
92 МТ меньше сахара, чем в прошлом году за аналогичный период.
С начала года общий транзит составил 269234 МТ, что на 6863 МТ больше сахара, чем в прошлом году за аналогичный период.
Таблица 6. Регионы-лидеры по отгрузкам за 01.11.2015 — 30.11.2015, МТ
| Регионы — лидеры по отгрузкам | МТ |
| Тамбовская область | 52055 |
| Белгородская область | 36071 |
| Липецкая область | 34333 |
| Воронежская область | 19626 |
| Пензенская область | 18172 |
| Краснодарский край | 17448 |
| Татарстан | 15684 |
| Курская область | 15313 |
| Алтайский край | 6592 |
| Башкортостан | 6296 |
Таблица 7.
 Регионы-лидеры по получению за 01.11.2015 — 30.11.2015, МТ
Регионы-лидеры по получению за 01.11.2015 — 30.11.2015, МТ| Регионы — лидеры по получению | МТ |
| Московская область | 32110 |
| Челябинская область | 24916 |
| Новосибирская область | 23107 |
| Ленинградская область | 21030 |
| Свердловская область | 17643 |
| Омская область | 13176 |
| Красноярский край | 9993 |
| Самарская область | 9075 |
| Башкортостан | 8069 |
| Пермский край | 7974 |
Таблица 8.
 Компании-лидеры по внутренним отгрузкам за 01.11.2015 — 30.11.2015, МТ
Компании-лидеры по внутренним отгрузкам за 01.11.2015 — 30.11.2015, МТ Таблица 9. Компании-лидеры по получению за 01.11.2015 — 30.11.2015, МТ
| Компании-лидеры по получению | МТ |
| АО ФИРМА «ЧЕЛЯБХИМОПТТОРГ» | 14574 |
| ООО ‘СЕРВИС-ЛАЙН’ | 8152 |
| ООО «РТ БАКАЛЕЯ» | 7794 |
| ЗАО *ЛК *ОЧАКОВО* | 7636 |
| ООО «КДВ Групп» | 5958 |
| РАМЕНСКАЯ РЕАЛБАЗА ХЛЕБОПРОДУКТОВ | 5892 |
| ООО «АГРОСНАБСАХАР» | 4931 |
| ООО «ТЛК ТРАНССИБУРАЛ» | 4644 |
| ООО «Юпитер» | 4075 |
| OOO «УPAЛTOPГПPEД» | 3932 |
Таблица 10.
 Компании-лидеры по экспорту за 01.11.2015 — 30.11.2015, МТ
Компании-лидеры по экспорту за 01.11.2015 — 30.11.2015, МТ| Компании-лидеры по экспорту | МТ |
| OOO «ЮЖHAЯ TPAHCПOPTHO-ЭKCПEДИЦИOHHAЯ KOMПAHИЯ» | 135 |
Таблица 11. Распределение отгрузок регионов-лидеров за 01.11.2015 — 30.11.2015, МТ
| Регион отправления | Регион получения | Всего, МТ |
| Всего | 160257 | |
| Тамбовская область | 52055 | |
| в том числе | Челябинская область | 5071 |
| Новосибирская область | 4937 | |
| Омская область | 4535 | |
| Ленинградская область | 3869 | |
| Свердловская область | 2545 | |
| Ульяновская область | 2367 | |
| Тюменская область | 2236 | |
| Пермский край | 2037 | |
| Бурятия | 1718 | |
| Самарская область | 1691 | |
| Белгородская область | 36071 | |
| в том числе | Московская область | 7928 |
| Белгородская область | 5695 | |
| Челябинская область | 2882 | |
| Свердловская область | 2785 | |
| Самарская область | 2510 | |
| Новосибирская область | 1929 | |
| Татарстан | 1289 | |
| Марий Эл | 1223 | |
| Омская область | 1152 | |
| Кировская область | 1016 | |
| Липецкая область | 34333 | |
| в том числе | Ленинградская область | 8007 |
| Челябинская область | 4742 | |
| Омская область | 3390 | |
| Свердловская область | 2822 | |
| Самарская область | 2213 | |
| Новосибирская область | 2082 | |
| Татарстан | 1221 | |
| Кемеровская область | 1083 | |
| Приморский край | 1083 | |
| Московская область | 943 | |
| Воронежская область | 19626 | |
| в том числе | Липецкая область | 4931 |
| Московская область | 1958 | |
| Свердловская область | 1941 | |
| Пермский край | 1754 | |
| Челябинская область | 1688 | |
| Самарская область | 1510 | |
| Новосибирская область | 815 | |
| Красноярский край | 680 | |
| Иркутская область | 680 | |
| Саратовская область | 476 | |
| Пензенская область | 18172 | |
| в том числе | Башкортостан | 5502 |
| Челябинская область | 3499 | |
| Ленинградская область | 2221 | |
| Новосибирская область | 1897 | |
| Тюменская область | 1146 | |
| Хакасия | 1014 | |
| Свердловская область | 671 | |
| Саратовская область | 602 | |
| Кемеровская область | 475 | |
| Саха (Якутия) | 337 |
Таблица 12.
 Основные поставщики по 10 ведущим областям за 01.11.2015 — 30.11.2015, МТ
Основные поставщики по 10 ведущим областям за 01.11.2015 — 30.11.2015, МТ
Таблица 13. Сахарные заводы-лидеры по отгрузкам белого сахара за 01.11.2015 — 30.11.2015, МТ
Перевозка больных Воронежская область
Перевозка больных (реанимационная, врачебная, фельдшерская, санитарная) из Воронежской области (Воронеж, Бобров, Богучар, Борисоглебск, Бутурлиновка, Калач, Лиски, Нововоронеж, Новохоперск, Острогожск, Павловск, Поворино, Россошь, Семилуки, Эртиль) в Москву с госпитализацией
02.04.2019Для обеспечения перевозки пациента из отделения реанимации больницы города Воронеж в больницу города Москвы, родственники пациента выбрали скорую медицинскую помощь нашей компании.
Житель Москвы, находясь на отдыхе, получил травму шейного отдела позвоночника. Друзья решили открыть «купальный сезон», и приехали на реку Усмань, один из местных водоёмов.К сожалению, мужчина не рассчитал силы, и прыжок с невысокого берега не был достаточным, для того чтобы погрузиться в воду с достаточной глубиной от берега. Произошёл удар головой о дно и повреждение 2 и 3 шейных позвонков.
Произошёл удар головой о дно и повреждение 2 и 3 шейных позвонков.
В тяжёлом состоянии, пациент был доставлен самими же друзьями, в больницу, и вскоре потребовалась искусственная вентиляция лёгких.
Для обеспечения своевременной и в полном объёме нейрохирургической помощи — пациенту требовался московский стационар.
Был выделен современный реанимобиль, с профессиональной бригадой медиков. Пациент принят на борт реанимобиля, продолжалась искусственная вентиляция лёгких, наркоз, обезболивание.
За время транспортировки пациента — оперативно была найдена клиника для лечения, где пациента ждали и были готовы «тут же» провести спасительное хирургическое вмешательству по прекращению сдавления травмированными позвонками спинного мозга.
Через 3 часа от поступления в клинику, пациент был максимально обследован и подан в операционную. Будем надеяться и верить в его благополучие.
Вызов скорой помощи и транспортировка
| Санитарная перевозка |
Линейная перевозка (вызов линейной бригады +перевозка) |
|
|---|---|---|
| Москва (в пределах МКАД) | 4 000 | 7 500 |
| Московская область до 10 км от МКАД | 8 000 | 11 500 |
| Московская область 10-30 км от МКАД | 8 500 | 12 500 |
| Московская область 30-45 км от МКАД | 9 000 | 13 500 |
| от 45-60 км от МКАД | 13 000 | 16 500 |
| от 60-100 км от МКАД | 8 000 + 125 руб/км | 12 000 + 125 руб/км |
| от 100-300 км от МКАД | 12 500 +100 руб/км | 14 500 + 120 руб/км |
| от 300-1000 км | 15 500 + 90 руб/км |
17 500 + 110 руб/км |
| от 1000-2000 км |
25 500 + 80 руб/км |
27 500 + 100 руб/км |
Остались
вопросы?
Услуги компании
НОВОЕ В РАЗДЕЛЕ
Продажа Меласса, фасованная меласса, целлюлоза
Патока свекольная — продукт переработки свеклы, содержащий большое количество полезных микроэлементов и витаминов. Его состав во многом зависит от климатических условий, мест произрастания свеклы, особенностей почвы, обработки продукта и его правильного хранения. Предлагаем приобрести патоку высокого качества, отвечающую требованиям ГОСТ, с доставкой по России и в другие страны.
Его состав во многом зависит от климатических условий, мест произрастания свеклы, особенностей почвы, обработки продукта и его правильного хранения. Предлагаем приобрести патоку высокого качества, отвечающую требованиям ГОСТ, с доставкой по России и в другие страны.
Преимущества мелассы
Патока сахарной свеклы служит сырьем для производства спирта, различных соусов и дрожжей для пекарен.Он также используется в кондитерской промышленности благодаря своим вкусовым свойствам и как заменитель сахара-песка, чтобы снизить производственные затраты. Кроме того, патока — эффективная добавка, используемая для обогащения рациона коров, овец, лошадей и других животных. Имеет массу полезных преимуществ, таких как:
- Отличные вкусовые качества и полезные свойства продукта;
- Широкий спектр применения в различных сферах производства;
- Повышение усвояемости и качества пищи;
Доступная стоимость
В качестве ингредиента комбикорма патока улучшает переваривание грубых сухих кормов животными. Он обогащает их рацион необходимыми пищевыми компонентами, нормализует работу кишечника, повышает аппетит и улучшает вкус молока, производимого у крупного рогатого скота.
Он обогащает их рацион необходимыми пищевыми компонентами, нормализует работу кишечника, повышает аппетит и улучшает вкус молока, производимого у крупного рогатого скота.
Состав продукта
Меласса часто используется в кулинарии в виде сиропа, так как это один из немногих подсластителей, богатых питательными веществами. Имеет вязкую консистенцию темно-коричневого цвета, с запахом продуктов карамелизации сахарозы. Углеводы состоят из 58-60% углеводов и включают 20-25% воды, до 9% азотистых соединений, кальций, калий, натрий, кремний и другие важные элементы.
Особенности использования фасованной мелассы
Свекольная меласса используется как сырье при производстве спирта и его производных. Выход спирта — 300 литров на тонну. Крупные предприятия ежемесячно потребляют около 200-300 тонн патоки. Характеристики качества сырья и его органолептические характеристики: вкус, цвет и запах. Вот почему так важно покупать патоку у ответственного производителя. Получение из него пекарских дрожжей — тоже давно разработанный и применяемый процесс.Из 100 кг мелассы готовят около 100 кг прессованных дрожжей с содержанием 25% сухого вещества.
Получение из него пекарских дрожжей — тоже давно разработанный и применяемый процесс.Из 100 кг мелассы готовят около 100 кг прессованных дрожжей с содержанием 25% сухого вещества.
Меласса также используется как обычный кормовой компонент. Использование этого продукта положительно влияет на продуктивность коров, так как способствует быстрому перевариванию твердых веществ и улучшает микробную активность. Коктейль из патоки вводят в рацион следующим образом. Рекомендуется начинать с 1/3 суточной дозы, затем постепенно, в течение нескольких дней, доводя количество добавки до полной дозы.Для получения готовой смеси литр патоки разводят в шести литрах теплой воды и приправляют кормом или добавляют в пойло. Эта смесь также хороша для питания лошадей. Его ежедневно добавляют на корму или растворяют в воде в пропорции 1: 4.
Патока свекольная — где купить по доступной цене?
Реализуем патоку свекольную для спиртовой и дрожжевой промышленности, кондитерских фабрик и ферм, произведенную из натуральных и экологически чистых компонентов. У нас вы можете купить патоку, изготовленную по всем требованиям ГОСТ, не содержащую антибиотиков и ГМО.
У нас вы можете купить патоку, изготовленную по всем требованиям ГОСТ, не содержащую антибиотиков и ГМО.
Реализуем мелассу оптом партиями с доставкой по всей территории России. Мы готовы проконсультировать нас по поводу наличия товара, условий оплаты и доставки. Для наших постоянных клиентов действуют особые условия!
Воронежская область, Россия гид
Обзор Воронежской области
Воронежская область ( Воронежская ) — субъект Российской Федерации, входит в состав Центрального федерального округа. Воронеж — столица области.
Население Воронежской области составляет около 2 335 000 человек (2015 г.), площадь — 52 216 кв. Км.
История Воронежской области
Первые люди начали селиться на территории нынешней Воронежской области в эпоху палеолита, около 30 тысяч лет назад. В железный век этот регион вошел в состав Скифии. Затем на смену скифам пришли сарматы. Предполагается, что именно они дали название реке Дон.
В раннем средневековье потомки сарматов аланы перешли к оседлому образу жизни, овладели навыками городской культуры и вошли в сложный симбиоз с кочевниками (булгарами и хазарами).В VII веке степная часть области стала территорией Хазарского каганата.
В IX-X веках славяне начали селиться на севере региона. Центральные и южные районы контролировались кочевыми племенами. В первой половине 13 века, во время нашествия монголов, древние русские поселения были разрушены, и воронежская земля на несколько столетий превратилась в так называемое «дикое поле», пересеченное основными татарскими дорогами — Ногайским и Кальмиусским.
Еще исторические факты…
В XV веке несколько уездов до реки Хопёр, реки Ворона и устья реки Воронеж входили в состав Рязанского княжества, но русских поселений здесь было немного. Между русской территорией и татарскими кочевниками лежала обширная, опустошенная набегами кочевников, нейтральная буферная земля.
В 1521 году Рязанское княжество вошло в состав Московского государства, что открыло путь для начала русской колонизации этих территорий. Казачество начало формироваться из христианского населения региона, ассимилировавшего определенные элементы культуры кочевников.
Казачество начало формироваться из христианского населения региона, ассимилировавшего определенные элементы культуры кочевников.
В 1585 году на месте казачьей станицы был основан Воронеж как крепость Московского государства на окраине Дикого поля. Более 50 лет Воронеж был единственным городом на территории нынешней Воронежской области. Вплоть до 17 века продолжались набеги татар на воронежскую землю.
В 1696 году по решению и при личном участии Петра I на Воронежской земле была построена верфь для постройки первого русского флота — плацдарма освоения Причерноморья.Отсюда и начались Азовские походы Петра I. Центрами русской колонизации на востоке области были города Борисоглебск (1698 г.) и Новохоперск (1716 г.).
В 1711 году (после потери Азова) Воронеж стал губернским городом, административным центром Азовской губернии. В 18 веке началось освоение всей территории региона. В 1725 году губерния получила название Воронежская.
Воронежская губерния стала одной из главных хлебных корзин Российской Империи. В 1860-1870-е годы по территории области проходили железные дороги, которые связывали Центральную Россию с Южной Украиной, Северным Кавказом и Заволжьем. Экономика региона оставалась в основном аграрной.
В 1860-1870-е годы по территории области проходили железные дороги, которые связывали Центральную Россию с Южной Украиной, Северным Кавказом и Заволжьем. Экономика региона оставалась в основном аграрной.
В 1934 году образована Воронежская область. В 1937 году Тамбовская область была выделена из Воронежской области. Во время Второй мировой войны он стал ареной ожесточенных сражений. Практически полностью разрушен город Воронеж. В 1954 году большие западные и северные территории были переданы Белгородской и Липецкой областям.В 1957 году границы Воронежской области приняли нынешний вид.
В середине 1960-х годов была построена Нововоронежская АЭС, по территории края прошел газопровод Ставрополь-Москва. Воронеж стал крупным центром военно-промышленного комплекса страны. В 1972 году было создано Воронежское водохранилище.
Природа Воронежской области
Березы посреди поля в Воронежской области
Автор: Степыгин Евгений
Золотая осень в Воронежской области
Автор: Константин Силкин
Коровы в Воронежской области
Автор: Галина Линн
Особенности Воронежской области
Воронежская область расположена на юго-западе европейской части России. Протяженность области с севера на юг 277,5 км, с запада на восток — 352 км. На юге граничит с Луганской областью Украины.
Протяженность области с севера на юг 277,5 км, с запада на восток — 352 км. На юге граничит с Луганской областью Украины.
Климат умеренно-континентальный. Средняя температура января — минус 10 градусов по Цельсию, июля — плюс 20 градусов по Цельсию.
Крупнейшие города области: Воронеж (1 032 000), Борисоглебск (63 000), Россошь (62 600), Лиски (54 400).
Важнейшим ресурсом Воронежской области является плодородный чернозем, богатый гумусом (чернозем), занимающий большую часть территории.Самые крупные реки — Дон, Воронеж, Хопёр, Битюг.
Воронежская область богата месторождениями неметаллического сырья, в основном строительных материалов (пески, глины, мел, граниты, цементное сырье, охра, известняк, песчаник). Также есть месторождения фосфоритов, никеля, меди и платины.
Экономика здесь индустриально-аграрная. Основные отрасли промышленности — машиностроение, электроэнергетика, химическая промышленность и переработка сельскохозяйственной продукции. Этот регион является крупным поставщиком сельскохозяйственной продукции: пшеницы, сахарной свеклы, подсолнечника, картофеля и овощей. На территории Воронежской области находится АЭС — Нововоронежская АЭС.
Этот регион является крупным поставщиком сельскохозяйственной продукции: пшеницы, сахарной свеклы, подсолнечника, картофеля и овощей. На территории Воронежской области находится АЭС — Нововоронежская АЭС.
По территории Воронежской области проходят две федеральные трассы: Е 115 — М4 «Москва-Новороссийск» и Е 119 — М6 «Москва-Астрахань».
Достопримечательности Воронежской области
Воронежская область обладает значительным рекреационным и туристическим потенциалом.В области 7 исторических городов (Бобров, Богучар, Борисоглебск, Воронеж, Новохоперск, Острогожск, Павловск), около 2700 памятников истории и культуры, 20 музеев и 3 заповедника.
Сосновые леса и дубравы в долине реки Воронеж известны своим благоприятным влиянием на здоровье человека. Здесь много летних и зимних туристических баз и санаториев.
Основные достопримечательности Воронежской области:
- Природный архитектурно-археологический музей-заповедник Дивногорье в Лискинском районе — одна из самых популярных и узнаваемых достопримечательностей Воронежской области.
 Одна из главных достопримечательностей — церковь, построенная монахами внутри меловой скалы;
Одна из главных достопримечательностей — церковь, построенная монахами внутри меловой скалы; - Археологический музей-заповедник «Костёнки» в селе Костёнки Хохольского района;
- Музей-усадьба Д. В. Веневитинова в селе Новоживотино Рамонского района — комплекс жилых и парковых построек, принадлежавший старинному русскому дворянскому роду второй половины XVII — начала XX веков;
- Замок принцессы Ольденбургской в Рамони — живописная усадьба, построенная в стиле кирпичной неоготики в конце 19 века;
- Воронежский биосферный заповедник с единственным в мире экспериментальным питомником бобра;
- «Село 17-19 веков» — музей под открытым небом в городе Эртиль;
- Хреновская и Чесменская конезаводы;
- Музеи и мемориальные места Воронеже.
Русагро: О нас
Группа Русагро — крупнейший в России вертикально интегрированный агрохолдинг. В настоящее время она является лидером на рынке производства сахара, свинины, растениеводства, масла и жиров. Земельный банк Группы составляет 637 тысяч гектаров. В 2015 году ряд инвестиционных банков назвал Группу «Русагро» одной из самых прибыльных и быстрорастущих компаний в сфере потребительских товаров в СНГ. Компания котируется как на Лондонской фондовой бирже, так и на Московской фондовой бирже.
Земельный банк Группы составляет 637 тысяч гектаров. В 2015 году ряд инвестиционных банков назвал Группу «Русагро» одной из самых прибыльных и быстрорастущих компаний в сфере потребительских товаров в СНГ. Компания котируется как на Лондонской фондовой бирже, так и на Московской фондовой бирже.
Основные активы Группы Русагро расположены в Белгородской, Тамбовской, Свердловской, Саратовской, Самарской, Курской, Воронежской и Орловской областях, а также в Приморском крае, что позволяет нам диверсифицировать наш бизнес на региональной основе. Штаб-квартира Группы находится в Тамбове, а представительство — в Москве.
Передовые технологии лежат в основе нашего бизнеса и интегрированы во все, что мы делаем, как с точки зрения оборудования, так и с точки зрения методов управления.
География продаж Русагро постоянно растет и развивается.В настоящее время мы продаем нашу продукцию более чем в 80 регионах России и более чем в 50 странах мира.
Продукция Русагро продается под следующими торговыми марками:
МЯСНЫЙ БИЗНЕС | ||||
|---|---|---|---|---|
Русский Сахар Чайкофский Брауни Пн Кафе Теплые традиции | Мечта хозяйки Щедрое Лето ЭЖК Готовим Дома Маслава СояКо Эксперт по кулинарии Формула чистоты Колибри Фиори | Слово Мясника |
Компания имеет гр. 20000 сотрудников. Группа считает своих сотрудников своим самым большим и самым важным активом. Таким образом, это дает им возможность раскрыть свой потенциал, развить свои знания и навыки и принять участие в наших многочисленных интересных и инновационных проектах.
20000 сотрудников. Группа считает своих сотрудников своим самым большим и самым важным активом. Таким образом, это дает им возможность раскрыть свой потенциал, развить свои знания и навыки и принять участие в наших многочисленных интересных и инновационных проектах.
Корпоративная социальная ответственность — неотъемлемая и важная часть бизнеса Группы Русагро. Компания активно способствует развитию регионов, в которых мы работаем. Мы серьезно относимся к своим обязательствам по защите окружающей среды.Мы также поддерживаем высокие этические стандарты в отношении охраны труда и техники безопасности, своевременной уплаты налогов и заработной платы, а также осуществления широкого спектра благотворительной деятельности.
История одного из крупнейших вертикально-интегрированных сельскохозяйственных холдингов в России и СНГ началась в 1995 году с операций по импорту сахара, а затем и с импорта и переработки сахарного тростника-сырца в России. Вскоре стал формироваться холдинг, который условно можно разделить на следующие ключевые этапы:
| Производство овощей на душу населения: CF: Воронежская область (кг) | 245. 000
2016 г. 000
2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: CF: г. Москва (кг) | 3.000 2016 г. | ежегодно | 2012 — 2016 |
| Производство овощей на душу населения: УФ: Тюменская область: Тюменская область без площадей (кг) | 122.000 2016 г. | ежегодно | 2013 — 2016 |
| Производство овощей на душу населения: СФ: Республика Крым (кг) | 197 000
2016 г. | ежегодно | 2014 — 2016 |
| Производство овощей на душу населения: SF: город Севастополь (кг) | 6.000 2016 г. | ежегодно | 2014 — 2016 |
| Производство овощей на душу населения: Северо-Кавказский федеральный округ (СК) (кг) | 279,000 2016 г. | ежегодно | 2006 — 2016 |
| Производство овощей на душу населения: Южный федеральный округ с 2010 г. (SF) (кг) | 276.000
2016 г. | ежегодно | 2006 — 2016 |
| Производство овощей на душу населения: ВР: Оренбургская область (кг) | 434,000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: VR: Пензенская область (кг) | 140.000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: VR: Пермский край (кг) | 88,000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: ВР: Самарская область (кг) | 112..jpg) 000
2016 г. 000
2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: ВР: Саратовская область (кг) | 206 000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: VR: Ульяновская область (кг) | 108.000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: Уральский федеральный округ (УФ) (кг) | 63,000
2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: УФ: Челябинская область (кг) | 66.000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: УФ: Курганская область (кг) | 212 000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: УФ: Свердловская область (кг) | 38.000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: УФ: Тюменская область: Ханты-Мансийский район (кг) | 13,000
2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: УФ: Тюменская область: Ямало-Ненецкий округ (кг) | 0.000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: Сибирский федеральный округ (СФ) (кг) | 84 000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: SB: Республика Алтай (кг) | 58.000
2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: SB: Республика Бурятия (кг) | 55,000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: SB: Республика Тыва (кг) | 11.000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: SB: Республика Хакасия (кг) | 115 000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: СБ: Алтайский край (кг) | 118. 000
2016 г. 000
2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: SB: Красноярский край (кг) | 83 000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: SB: Иркутская область (кг) | 64.000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: SB: Кемеровская область (кг) | 89 000
2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: СБ: Новосибирская область (кг) | 74.000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: ИП: Республика Саха (Якутия) (кг) | 40 000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: ИП: Хабаровский край (кг) | 46.000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: ИП: Камчатский край (кг) | 58,000
2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: ИП: Магаданская область (кг) | 39.000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: ИП: Сахалинская область (кг) | 89 000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: ИП: Еврейская автономная область (кг) | 176.000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: ИП: Чукотский край (кг) | 2. 000
2016 г. 000
2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения (кг) | 123.000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: CF: Белгородская область (кг) | 176 000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: CF: Липецкая область (кг) | 143.000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: CF: Рязанская область (кг) | 95 000
2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: CF: Смоленская область (кг) | 72.000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: Северо-запад: Республика Карелия (кг) | 27,000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: Северо-Запад: Республика Коми (кг) | 26.000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: Северо-запад: Вологодская область (кг) | 56,000
2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: Северо-запад: Калининградская область (кг) | 70.000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: Северо-запад: Ленинградская область (кг) | 100 000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: СФ: Республика Адыгея (кг) | 164.000
2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: Северная Каролина: Республика Дагестан (кг) | 543,000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: Северная Каролина: Республика Ингушетия (кг) | 18.000 2016 г. | ежегодно | 1994 — 2016 |
| Производство овощей на душу населения: Северная Каролина: Республика Кабардино-Балкария (кг) | 512 000
2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: СФ: Республика Калмыкия (кг) | 103.000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: Северная Каролина: Республика Карачаево Черкесия (кг) | 178 000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: Северная Каролина: Республика Северная Осетия Алания (кг) | 44. 000
2016 г. 000
2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: Северная Каролина: Чеченская Республика (кг) | 38 000 2016 г. | ежегодно | 2003 — 2016 гг. |
| Производство овощей на душу населения: СФ: Краснодарский край (кг) | 168.000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: СФ: Астраханская область (кг) | 1 127 000
2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: СФ: Волгоградская область (кг) | 465.000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: Приволжский федеральный округ (ВР) (кг) | 140 000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: VR: Республика Татарстан (кг) | 103.000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: VR: Удмуртская Республика (кг) | 150 000
2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: VR: Республика Чувашия (кг) | 138.000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: ВР: Кировская область (кг) | 75 000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: VR: Нижегородская область (кг) | 111.000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: УФ: Тюменская область (кг) | 55,000
2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: SB: Омская область (кг) | 123.000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: SB: Томская область (кг) | 87 000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: СБ: Забайкальский край (кг) | 31.000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: Дальневосточный федеральный округ (ДФ) (кг) | 69 000
2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: ИП: Приморский край (кг) | 85.000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: ИП: Амурская область (кг) | 86 000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: Центральный федеральный округ (ЦФО) (кг) | 83.000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: CF: Брянская область (кг) | 122 000
2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: CF: Владимирская область (кг) | 127.000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: CF: Ивановская область (кг) | 75 000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: CF: Калужская область (кг) | 119.000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: CF: Костромская область (кг) | 186 000
2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: CF: Курская область (кг) | 132.000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: CF: Московская область (кг) | 83 000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: CF: Орловская область (кг) | 111.000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: CF: Тамбовская область (кг) | 116 000
2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: CF: Тверская область (кг) | 83.000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: CF: Тульская область (кг) | 117,000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: CF: Ярославская область (кг) | 115.000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: Северо-Западный федеральный округ (СЗ) (кг) | 40 000
2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: Северо-запад: Архангельская область (кг) | 28.000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: СЗ: Архангельская область: Ненецкий округ (кг) | 2.000 2016 г. | ежегодно | 1995 — 2016 |
| Производство овощей на душу населения: Северо-запад: Мурманская область (кг) | 0.500
2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: Северо-запад: Новгородская область (кг) | 208 000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: Северо-запад: Псковская область (кг) | 71.000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: Северная Каролина: Ставропольский край (кг) | 162 000
2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: СФ: Ростовская область (кг) | 184.000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: VR: Республика Башкортостан (кг) | 89 000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: VR: Республика Марий Эл (кг) | 228.000 2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: VR: Республика Мордовия (кг) | 120 000
2016 г. | ежегодно | 1990 — 2016 |
| Производство овощей на душу населения: СЗ: Архангельская область: Архангельская область, искл… (кг) | 29 000 2016 г. | ежегодно | 2013 — 2016 |
Яровизация изменяет идентичность поглотителя и источника сахарной свеклы (Beta vulgaris) и обращает транслокацию флоэмы от стержневых корней к побегам
РЕЗЮМЕ
Во время вегетативного роста двухлетняя сахарная свекла поддерживает крутой градиент между побегами (источником) и хранением сахарозы стержневой корень (раковина).Для перехода от вегетативного к генеративному росту им требуется фаза охлаждения, называемая яровизацией. Здесь мы изучили динамику источника поглотителя сахарной свеклы при яровизации, вызванной холодными температурами, и выявили обратный сток главного корня до цветения в сторону обращения источника. Этот переход индуцируется транскриптомным и функциональным перепрограммированием ткани сахарной свеклы, что приводит к изменению направления потока в транспортной системе на большие расстояния — флоэме. В качестве ключевого процесса для этого перехода импортеры и экспортеры вакуолярной сахарозы, BvTST2; 1 и BvSUT4, регулируются противоположным образом, что приводит к повторной мобилизации сахаров из вакуолей, хранящих стержневые корни.Сопутствующие изменения в экспрессии генов регуляторов цветков предполагают, что расшифрованные теперь процессы являются предпосылкой для болтования. Таким образом, наши данные могут служить для анализа триггеров метаболизма и развития, которые являются потенциальными мишенями для редактирования генома или селекционных подходов.
Этот переход индуцируется транскриптомным и функциональным перепрограммированием ткани сахарной свеклы, что приводит к изменению направления потока в транспортной системе на большие расстояния — флоэме. В качестве ключевого процесса для этого перехода импортеры и экспортеры вакуолярной сахарозы, BvTST2; 1 и BvSUT4, регулируются противоположным образом, что приводит к повторной мобилизации сахаров из вакуолей, хранящих стержневые корни.Сопутствующие изменения в экспрессии генов регуляторов цветков предполагают, что расшифрованные теперь процессы являются предпосылкой для болтования. Таким образом, наши данные могут служить для анализа триггеров метаболизма и развития, которые являются потенциальными мишенями для редактирования генома или селекционных подходов.
Введение
Растения изменяют не только форму и размер своих органов, но также физиологические и молекулярные свойства этих структур во время развития и в ответ на раздражители окружающей среды.Как правило, приемные органы растений зависят от импорта углеводов, в основном сахарозы, из исходных органов. Однако предыдущие органы-поглотители могут дифференцироваться в «источники», которые затем, в свою очередь, обеспечивают мобилизованные продукты хранения для вновь возникающих поглотителей.
Однако предыдущие органы-поглотители могут дифференцироваться в «источники», которые затем, в свою очередь, обеспечивают мобилизованные продукты хранения для вновь возникающих поглотителей.
Относительная сила поглотителей и источников может регулироваться активностью ферментов, синтезирующих и разлагающих сахарозу (Herbers and Sonnewald, 1998), и изменением активности загрузчиков сахарозы, расположенных во флоэме (Imlau et al., 1999; Готтвальд и др., 2000; Шривастава и др., 2008; Chen et al., 2012). Как следствие, как ферменты, метаболизирующие сахарозу, так и переносчики представляют собой цели, актуальные для селекционных стратегий, направленных на повышение урожайности сельскохозяйственных культур (Ludewig and Sonnewald, 2016; Sonnewald and Fernie, 2018).
Сахароза — это первичный сахар, транспортируемый во флоэме от источника к органам-приемникам. После разгрузки в раковинах сахароза может использоваться в качестве прекурсора энергии и в качестве строительного блока для биосинтеза соединений для роста и хранения. Незеленые запасающие органы, такие как клубни или стержневые корни, должны поддерживать крутой источник для градиента опускания. Для этого импортированная сахароза быстро превращается в относительно инертные запасные соединения, такие как крахмал, или внутриклеточно разделяется на большие клеточные вакуоли. Как уже говорилось, идентичности источников и источников растений являются динамическими, и соответствующие переходы инициируются после появления эндогенных сигналов развития (Turgeon, 1989) или в ответ на специфические стимулы окружающей среды (Roitsch, 1999).Таким образом, динамическое регулирование генов и ферментов, участвующих в метаболизме углеводов и импорте сахаров во флоэму мобилизующих запасающих органов, является ключевым для установления источника бывших поглотителей (Viola et al., 2007; Liu et al., 2015; O’Neill et al., al., 2013; Boussiengui-Boussiengui et al., 2016).
Незеленые запасающие органы, такие как клубни или стержневые корни, должны поддерживать крутой источник для градиента опускания. Для этого импортированная сахароза быстро превращается в относительно инертные запасные соединения, такие как крахмал, или внутриклеточно разделяется на большие клеточные вакуоли. Как уже говорилось, идентичности источников и источников растений являются динамическими, и соответствующие переходы инициируются после появления эндогенных сигналов развития (Turgeon, 1989) или в ответ на специфические стимулы окружающей среды (Roitsch, 1999).Таким образом, динамическое регулирование генов и ферментов, участвующих в метаболизме углеводов и импорте сахаров во флоэму мобилизующих запасающих органов, является ключевым для установления источника бывших поглотителей (Viola et al., 2007; Liu et al., 2015; O’Neill et al., al., 2013; Boussiengui-Boussiengui et al., 2016).
Сахарная свекла ( Beta vulgaris ), основной вид сельскохозяйственных культур, обеспечивающих промышленную сахарозу в умеренных зонах Европы и Северной Америки, демонстрирует двухлетний жизненный цикл и формирует большой стержневой корень в течение первого года своего развития. Этот стержневой корень представляет собой обратимую раковину, которая содержит до 20% своей сырой массы в виде сахарозы. Вакуолярный загрузчик сахарозы, названный TONOPLAST SUGAR TRANSPORTER2; 1 ( Bv TST2; 1), был идентифицирован как ключевой элемент для накопления сахара в этом запасающем органе (Jung et al., 2015). В течение второго года стержневой корень обеспечивает ранее хранившуюся сахарозу в качестве предшественника для образования заметно большого соцветия.
Этот стержневой корень представляет собой обратимую раковину, которая содержит до 20% своей сырой массы в виде сахарозы. Вакуолярный загрузчик сахарозы, названный TONOPLAST SUGAR TRANSPORTER2; 1 ( Bv TST2; 1), был идентифицирован как ключевой элемент для накопления сахара в этом запасающем органе (Jung et al., 2015). В течение второго года стержневой корень обеспечивает ранее хранившуюся сахарозу в качестве предшественника для образования заметно большого соцветия.
Появление соцветий сахарной свеклы строго зависит от предшествующей фазы низких температур, которая вызывает молекулярное перепрограммирование, известное как яровизация.Это зависящее от яровизации болтование приводит к значительной потере сахара и биомассы главного корня и, следовательно, урожайности. Эта потеря урожая способствует тому, что сахарная свекла выращивается исключительно как однолетняя культура. Соответственно, сахарную свеклу сеют весной и собирают поздней осенью. Таким образом, продолжительный период выращивания (особенно с осени по осень) и, таким образом, выявление устойчивых к завинчиванию сортов стали первоочередными задачами селекции сахарной свеклы в последние десятилетия (Hoffmann and Kluge-Severin, 2011; Hoffmann and Kenter, 2018).
В последние годы в геноме сахарной свеклы были идентифицированы два основных локуса раннего связывания, B и B2 , которые кодируют ген регулятора псевдореклика BOLTING TIME CONTROL 1 , BTC1 (Pin et al., 2012) и DOUBLE B-BOX TYPE ZINC FINGER белок BvBBX19 (Dally et al., 2014) соответственно. В однолетней свекле экспрессия обоих генов приводит к репрессии гена репрессора цветков FT1 и последующей индукции гена индуктора цветков FT2 и независимому от яровизации цветению в длинные дни (Pin et al., 2010; Dally et al., 2014). Двухлетняя свекла гомозиготна по рецессивным аллелям btc1 и bbx19 , которые кодируют нефункциональные белки, неспособные репрессировать ингибирующую функцию FT1 (Pfeiffer et al., 2014). Соответственно, двулетняя сахарная свекла требует яровизации для BTC1- и BBX19-независимой репрессии и цветения FT1 (Pin et al., 2010). Очевидно, что индукция цветения и переход сток-источник должны быть тесно взаимосвязаны в сахарной свекле. Скоординированная сеть цветочных индукторов и репрессоров инициирует переход к образованию болтов после яровизации, но регулировка метаболической установки оказывается не менее важной для морфологической и физиологической реструктуризации стержневых корней до образования соцветий.Однако имеется мало информации о молекулярно-физиологических процессах в сахарной свекле на ранних этапах яровизации.
В этой работе мы поэтому стремились понять, как низкие температуры, представляющие условие sine qua non для яровизации, могут влиять на метаболизм сахара, фотосинтез, транслокацию флоэмы и, следовательно, на идентичность побегов и стержневых корней источника и поглотителя. Мы объединили всесторонний анализ транскриптома и протеома с записью характеристик роста органов, фотосинтетических параметров и количественной оценки метаболитов.Таким образом, наш анализ выявил неожиданное зависящее от холода изменение идентичности поглотителя и источника стержневых корней и побегов, соответственно, до забивания на самых ранних стадиях яровизации.
Несмотря на инактивацию фотосинтеза на холоде, биомасса побегов увеличивалась за счет сахарозы стержневого корня. Мы зафиксировали значительный экспорт сахара из корнеплодов на холоде, что коррелирует с изменением активности экс- и импортеров сахара и с заметно измененной экспрессией генов, участвующих либо в синтезе, либо в деградации сахарозы.Мы предполагаем, что это до сих пор скрытое метаболическое перепрограммирование является предпосылкой для начала связывания, поскольку соответствующее перенаправление потока транспортирует сахара от стержневого корня к побегу. Однако этот процесс также может способствовать ярко выраженной морозостойкости сахарной свеклы. Таким образом, наши результаты дают молекулярно-физиологическое объяснение хорошо известной проблемы выращивания сахарной свеклы (потеря урожая из-за двухлетнего жизненного цикла) и предоставляют новые цели для достижения устойчивости к болтованию и зимостойкости у этого вида сельскохозяйственных культур.
Результаты
Воздействие холода вызывает быструю потерю воды в побегах и корнях, но не в производстве биомассы побегов. гибридные генотипы (GT1, GT2 и GT3) (первоначально выращенные в контрольных условиях [20 ° C], затем акклиматизированные в течение одной недели при 12 ° C) в течение 19 дней после перевода в холодные (4 ° C) условия (
, рис. ). Сухая масса побегов (DW), но не сырая масса (FW), продолжала увеличиваться во время выдержки растений до 4 ° C.Следовательно, содержание воды в побегах постепенно уменьшалось почти вдвое в конце записанного времени (, рис. 1A, ). Одновременно FW, а также DW в корневых корнях уменьшились вместе с содержанием воды в корневых корнях в течение периода воздействия холода ( Рисунок 1A, B ). Эти результаты показали, что рост стержневых корней пострадал в большей степени, чем рост побегов на холоде, и предположили дифференциальные физиологические и метаболические реакции тканей побега и корня на воздействие холода. Рисунок 1.Реакция накопления биомассы и сахара на низкие температуры в побегах и стержневых корнях 6-недельных растений сахарной свеклы трех разных генотипов (GT1 = серый квадрат; GT2 = синий кружок; GT3 = коричневый треугольник). Растения выращивали в течение шести недель при 20 ° C, затем переносили на 12 ° C на одну неделю и затем на 4 ° C (начало регистрации биомассы и накопления сахара) на 19 дней. Для каждой точки данных в полдень собирали целые органы (побеги или стержневые корни). Точки данных показывают средние значения от n = 6 до 10 растений ± стандартное отклонение. (A, B) Свежая масса (FW), сухая масса (DW) и влажность побегов и корней. (C, D) Накопление сахара и крахмала в течение периода охлаждения (4 ° C) в побегах и стержневых корнях соответственно. Значительные изменения в контрольных условиях (первая точка данных) рассчитывали с использованием двустороннего критерия Стьюдента t (* = p <0,05).
Уровни сахара в побегах и стержневых корнях ведут себя по-разному на холоде
Накопление растворимых сахаров в побегах — обычная реакция на низкие температуры и часть процесса акклиматизации к холоду многих видов растений (Steponkus, 1971; Wolfe and Bryant, 1999; Strand и другие., 1997). Кроме того, в нашем анализе роста в зависимости от холода листовой материал (полученный из тех же растений сахарной свеклы, которые использовались для расчета биомассы и содержания воды (, рис. 1A )) продемонстрировал явное увеличение уровней глюкозы и фруктозы (и в меньшей степени дисахарид сахарозы) после переноса на 4 ° C ( Рисунок 1C ). В отличие от растворимых сахаров, содержание крахмала в листьях во всех трех генотипах быстро снижалось после переноса до 4 ° C, достигая 20-33% от значения, присутствующего до переноса ( Рисунок 1C, крайняя правая панель ).
В ткани стержневого корня динамика накопления сахара заметно отличалась от таковой в побегах. Уровни глюкозы и фруктозы немного повышаются на холоде, но достигают лишь 10–20 процентов от концентрации моносахаридов в листьях. Перед переносом на 4 ° C уровни сахарозы главного корня превышали уровни моносахаридов в 30-100 раз. Уровни крахмала стержневого корня всех генотипов были чрезвычайно низкими и практически не менялись во время обработки холодом (, рис. 1D, ). Однако три проанализированных генотипа показали разную динамику накопления сахара и крахмала на холоде.В то время как уровни сахарозы главного корня GT2 и GT3 явно снижались на холоду, уровни сахарозы GT1 колебались лишь незначительно. Интересно, что резкое падение концентрации сахарозы в стержневых корнях GT3 (примерно на 400 мкмоль / г DW) и в меньшей степени в GT2 (примерно на 200 мкмоль / г DW) не сопровождалось пропорциональным увеличением моносахаридов, как могло бы быть. ожидается исключительно для гидролиза сахарозы. Эти огромные потери сахарозы главного корня скорее предполагали, что этот сахар либо (i) более интенсивно вдыхался, (ii) превращался в соединения, отличные от моносахаридов, глюкозы и фруктозы, либо (iii) экспортировался из ткани стержневого корня в другие органы.В дальнейшем мы стремились выяснить судьбу сахарозы в отношении этих возможностей.
Воздействие холода влияет на скорость фотосинтеза и ассимиляцию углекислого газа
У устойчивых к холоду растений, таких как арабидопсис, сахар накапливается в листьях на холоде, когда фотосинтетическая активность сохраняется во время снижения нагрузки сахарозной флоэмы и увеличения импорта сахара в вакуоли клеток мезофилла листа (Strand et al. al., 1997; Wingenter et al., 2010; Pommerrenig et al., 2018). Мы проанализировали влияние холода на фотосинтез сахарной свеклы с помощью флуорометрии с амплитудно-импульсной модуляцией (PAM) и ассимиляции CO 2 с измерениями газообмена (, рис. 2, ).Эти измерения показали, что квантовый выход Фотосистемы II (Y (II)), концентрация CO 2 листа ( C i ), скорость ассимиляции CO 2 ( A ) и скорость транспирации листьев ( E ). ) зависели от температуры окружающей среды, и растения, подвергшиеся воздействию холода, реагировали снижением фотосинтетической эффективности (, рис. 2, ). Все три генотипа показали небольшое, но значительное снижение Y (II) уже после одной недели перевода на 12 ° C.Одновременно нефотохимическое тушение Y (NPQ) увеличивалось, а нерегулируемое рассеяние энергии Y (NO) уменьшалось при этой температуре в листьях всех трех генотипов (, рис. 2A, ). Более высокий квантовый выход Y (NPQ) при 12 ° C по сравнению с 20 ° C указывает на повышенный поток электронов в направлении пути Mehler-Ascorbateperoxidase (Asada et al., 1998) при воздействии этой температуры, чтобы претерпеть, например, диссипация тепловой энергии на реакционных центрах Фотосистемы II. После перехода на 4 ° C Y (II) еще больше уменьшился и не восстанавливался в течение испытанного периода времени.Однако уменьшение квантового выхода Y (NPQ) и значительное увеличение квантового выхода Y (NO) указывало на то, что электроны подвергались нерегулируемой диссипации энергии, которая могла вызвать свободные радикалы и повреждение мембраны при такой низкой температуре ( Рисунок 2A ). Измерения газообмена CO 2 показали, что снижение активности ФСII, определенное с помощью флуорометрии PAM, сопровождалось резким снижением скорости ассимиляции CO 2 ( A ) при 4 ° C, но не при 12 ° C ( Рисунок 2B ).Скорость транспирации ( E ) временно увеличивалась во всех трех генотипах уже при 12 ° C, но более резко при 4 ° C. Повышенная транспирация совпала с зависящим от холода увеличением концентрации CO 2 в листьях, что указывает на то, что, несмотря на увеличенное раскрытие устьиц, активность ферментов цикла Кальвина была значительно снижена ( Рисунок 2B ).
Рис. 2.Параметры фотосинтеза, ассимиляция CO 2 и данные экспрессии листьев сахарной свеклы после воздействия холода.Растения сахарной свеклы трех генотипов (GT1 = серый квадрат; GT2 = синий кружок; GT3 = коричневый треугольник) выращивали в течение шести недель при 20 ° C, затем переносили при 12 ° C на одну неделю и затем на 4 ° C в течение трех недель. . (A) Измерения PAM листьев трех разных генотипов. Квантовый выход фотосинтеза [Y (II)], нефотохимического тушения [Y (NPQ)] и нерегулируемого тушения [Y (NO)]. В каждый момент времени анализировали четыре растения на каждый генотип. (B) Измерение газообмена на тех же заводах, что и в A) .Показаны межклеточные концентрации CO 2 листа ( C i ), скорость ассимиляции CO 2 ( A ) и скорость транспирации ( E ). Для каждого измерения использовали четыре независимых растения. Для измерений в разные моменты времени после перевода в холодные условия использовали одни и те же растения. Значимые изменения в контрольных условиях (первая точка данных) были рассчитаны с использованием теста Стьюдента t (* = p <0,05). (C) Анализ главных компонентов (PC1 по сравнению с PC2) для трех генотипов на основе значений экспрессии 162 генов, связанных с фотосинтезом, извлеченных из данных последовательности РНК исходных листьев растений, выращенных при 20 ° C после воздействия 4 ° C или для контроля условий (20 ° C) в течение 14 дней соответственно. (D) Процент считываний РНК-Seq, аннотированных как гены, кодирующие белки, связанные с фотосинтезом (ФС). Круговые диаграммы представляют собой усредненные средние значения для трех разных генотипов при 20 ° C (контроль) и через 14 дней при 4 ° C. (D) Экспрессия RubisCO Activase ( Bv2_025300_tzou.t1 ), малая субъединица RubisCO ( Bv2026840_jycs_t1 ), Bv2026840_jycs_t1 ), Bv2026840_jycs_t1 , Bv2026840_jycs_t1 (916_B121_B1_B170012 (связывается с белком 1_B170012 916_B12 916_B12 916_B12, связывается с белком A / B12916 Bv_004160_hgjn.t1 ), Глутатионредуктаза 1 ( Bv3_069540_erom.t1 ), Глутатионредуктаза 2 ( Bv5_120360_utjpwm.t_1
17)t1 ), Аскорбатпероксидаза1 ( Bv1_007470_ymzt.t1 ). Данные представляют собой средние нормированные значения импульсов в минуту трех независимых анализов последовательности РНК для каждого генотипа и температурных условий ± стандартное отклонение. Звездочки представляют p -значения <0,05 в соответствии с двухсторонним тестом t по сравнению со значениями в контрольных условиях (20 ° C).Чтобы получить представление о глобальной зависимой от холода экспрессии генов в тканях источника и поглотителя сахарной свеклы, мы выполнили анализ РНК-seq на листьях и ткани главного корня растений сахарной свеклы из указанных выше генотипов, подвергшихся воздействию холода (4 ° C) или контрольной 20 ° C) условия.Образцы были собраны через 14 дней после переноса с 12 ° C на 4 ° C, т.е. когда метаболическое накопление сахаров (, рис. 1 ) и скорость фотосинтеза были максимально контрастными. Полученные считывания последовательности РНК были сопоставлены с эталонным геномом сахарной свеклы (Dohm et al., 2013). Данные секвенирования транскриптомов депонированы в архиве чтения последовательностей GenBank (BioProject PRJNA602804).
Воздействие холода вызвало глобальную перестройку экспрессии генов как в тканях побега, так и в тканях стержневого корня (дополнительный рисунок 1).Мы извлекли транскриптную информацию о генах, участвующих в фотосинтезе. В анализе на ПК, основанном на значениях экспрессии в ткани листа генов, обозначенных как «фотосинтез», «фотосинтез.световая реакция», «фотосинтез.Цикл кальвина» или «фотосинтез.фотодыхание» Mapman Ontology для сахарной свеклы, ПК1 разделял лечения в трех генотипах. PC1 объяснил 84,5%, PC2 7,1% вариации экспрессии между 4 ° C и 20 ° C в пределах генотипов ( Рисунок 2C ).Независимые генотипы не были четко разделены, и, соответственно, уровни экспрессии генов, связанных с фотосинтезом, вели себя одинаково во всех трех генотипах (, рисунок 2C, , дополнительный рисунок 1). При 20 ° C около 9% всех считываний транскриптов каждого генотипа можно отнести к подгруппам «фотосинтеза». После воздействия 4 ° C эта группа была представлена только 3% всех считываний, что указывает на резкое подавление генов, связанных с фотосинтезом, на холоде ( Рисунок 2D ). Подавление экспрессии, например, наблюдали для транскриптов, гомологичных генам, кодирующим активазу RubisCO (BvRCA), малую субъединицу RubisCo (BvRBCS), связывающий белок хлорофилла A / B (BvCABA) и пластоцианин (BvPC) ( Рисунок 2E, верхний ряд ).С другой стороны, гены, связанные с обработкой ROS, демонстрируют дифференциальную регуляцию. В то время как гены, кодирующие глутатионредуктазу, активировались на холоду, гены, кодирующие супероксиддисмутазу или аскорбатредуктазу, подавлялись или регулировались незначительно, соответственно (, рис. 2E, нижний ряд ). Таким образом, данные продемонстрировали, что фотосинтез сахарной свеклы был чрезвычайно чувствителен к пониженным температурам ниже 12 ° C, и предположили, что (почти не происходящая) ассимиляция CO 2 не полностью объясняет увеличение биомассы и сахара, определенного для холодных листьев -обработанная сахарная свекла ( Рисунок 1 ).
Холодные температуры изменяют метаболизм основных углеводов в побегах и корневых корнях
Мы исследовали, можно ли объяснить снижение концентрации сахарозы в главном корне на холоде усилением дыхания и могут ли холодные условия приводить к дифференциальной экспрессии генов, участвующих в основном метаболизме углеводов Рисунок 3) . Дыхание в ткани стержневого корня зависело от исследуемой части стержневого корня, так как оно уменьшалось с увеличением глубины окружающей почвы (рис. 3А) .Это зависимое от положения снижение дыхания (пропорционально глубине почвы, окружающей соответствующую часть стержневого корня) также наблюдалось при 4 ° C, однако в каждой части стержневого корня дыхание было — по сравнению с соответствующим контролем — в целом. ниже, когда сахарная свекла подвергалась воздействию 4 ° C (Рисунок 3A) . Эти данные свидетельствуют о том, что на холоде углеводы главного корня использовались для гликолитического и окислительного катаболизма в меньшей степени, чем при контрольных условиях 20 ° C.В побегах, то есть в исходных листьях всех генотипов, напротив, дыхание увеличивалось на холоде (Рисунок 3B) , что указывает на то, что зрелые листья, которые почти не усваивают CO 2 при этой температуре (Рисунок 2) , была высокая потребность в углеводах из других источников. Одним из этих источников, вероятно, был крахмал, содержание которого в листьях уменьшалось на холоде ( Рисунок 1 ). Компьютерный анализ и анализ тепловой карты, загруженные значениями экспрессии генов, обозначенных как «основной метаболизм СНО», выявили органозависимые и температурно-зависимые различия (Рисунок 3C , Рисунок 3D) .Первый главный компонент PC1 объясняет 66,9% различий в экспрессии между корнями и побегами, а PC2 составляет 17,9% различий в экспрессии между 20 ° C и 4 ° C. Оба органа показали более четкое разделение при 20 ° C по сравнению с 4 ° C (рис. 3C) . Представление тепловой карты показывает, что уровни экспрессии генов, участвующих в деградации и синтезе крахмала в листьях, были повышены (деградация крахмала) или понижены (синтез крахмала) под воздействием холода, соответственно.Несмотря на чрезвычайно низкие уровни крахмала в стержневых корнях (рис. 1) , гены, связанные с крахмалом, также экспрессировались и регулировались в стержневых корнях (рис. 3D) . Это наблюдение согласуется с отчетом Turesson et al. (2014), который показал, что ферменты метаболизма крахмала были активными, несмотря на отсутствие крахмала в стержневых корнях (Turesson et al., 2014).
Рисунок 3.Изменения в метаболизме основных углеводов и энергетическом состоянии в ответ на холод. (A) Дыхание (производство CO 2 ) различных областей главного корня из GT1 в контрольных условиях (20 ° C, желтые столбцы) или после переноса в течение одной недели до 4 ° C (синие столбцы). (B) Дыхание (продукция CO 2 ) из ткани листа трех генотипов (GT1, GT2, GT3) в контрольных условиях (20 ° C, желтые столбцы) или после 1-недельного переноса на 4 ° C (синие столбцы ). (C) Анализ главных компонентов (PC) (PC1 по сравнению с PC2) для трех генотипов на основе значений экспрессии 112 генов с аннотацией GO «основной метаболизм CHO» (нагрузки), извлеченных из данных последовательности РНК исходных листьев растений выращивали при 20 ° C и переносили на 1 неделю при 12 ° C, а затем 14 дней при 4 ° C или в контрольных условиях (20 ° C). (D) Анализ тепловой карты сгруппированных значений экспрессии, извлеченных из данных RNA-seq. К строкам было применено масштабирование единичной дисперсии. Строки сгруппированы с использованием манхэттенского расстояния и средней связи. (E) Значения экспрессии двух генов сахарозофосфат-синтазы ( BvSPSA1 и BvSPSA2 ), извлеченные из данных РНК-seq побегов и корней, и значения экспрессии для двух генов сахарозо-синтазы ( BvSUS1, и BvS2, выделенные BvS) из данных РНК-seq побегов и корней из GT1, GT2, GT3.Данные представляют собой средние нормированные значения импульсов в минуту трех независимых анализов последовательности РНК для каждого генотипа и температурных условий ± стандартное отклонение. (F) АТФ, соотношение АТФ / АДФ, энергетический заряд, ЕС = [АТФ] + 0,5 [АДФ] / [АТФ] + [АДФ] + [АМФ]. (E / F) Данные представляют собой средние значения ± стандартное отклонение. Звездочки представляют p -значения <0,05 в соответствии с двухсторонним тестом t по сравнению со значениями в контрольных условиях (20 ° C).
Уровни экспрессии генов синтеза сахарозы повышались в корнях на холоде, но не изменялись в побегах.Гены деградации сахарозы, однако, явно подавлялись в корнях, но слегка повышались в побегах (рис. 3D) . Фосфат-синтаза сахарозы (SPS) и синтаза сахарозы (SUS) являются ключевыми факторами биосинтеза и деградации сахарозы и регулируют распределение углеводов между исходными и поглощающими тканями (Voll et al., 2014; Sturm, 1996; Martin et al., 1993; Kovtun and Daie, 1995). Полногеномный поиск в геноме сахарной свеклы (RefBeet 1.2, (Dohm et al., 2013)) выявил две изоформы SPS и четыре изоформы SUS.Байесовский анализ идентифицировал обе изоформы SPS как гомологи подгруппы Arabidopsis SPS ‘A’ (Voll et al., 2014) (дополнительный рисунок 3). Две изоформы SPS продемонстрировали дифференциальную органоспецифичную и зависимую от холода экспрессию. В побегах всех генотипов экспрессия SPSA1 была примерно в 10 раз выше, чем в корнях, когда растения подвергались воздействию 20 ° C. Обработка холодом увеличивала его экспрессию в корнях до семи раз, но не влияла на уровни экспрессии в побегах. Экспрессия SPSA2 при 20 ° C была низкой в побегах, но высокой в корнях всех трех протестированных генотипов.Экспрессия этой изоформы ранее была идентифицирована как специфическая для стержневого корня, индуцированная глюкозой и подавленная сахарозой (Hesse et al., 1995). Экспрессия SPSA2 также не изменялась или даже подавлялась (в случае GT2) в побегах после обработки холодом, но, в отличие от SPSA1, экспрессия SPSA2 индуцировалась в основных корнях всех генотипов. На уровне белка, выявленном с помощью анализа растворимого протеома из тех же самых тканей главного корня, который использовался для анализа транскриптома с помощью MS-анализа, BvSPSA1, но не BvSPSA2, был слегка повышен.Однако активность SPS была выше при температуре 4 ° C по сравнению с 20 ° C в экстрактах белков из листьев и стержневых корней ( Дополнительная фигура 3 ) . Более высокие уровни UDP в стержневых корнях и сахароза-6-фосфат в побегах на холоде по сравнению с контрольными температурами наряду с повышенными уровнями аллостерического активатора SPS G-6-P (Huber and Huber, 1992) подтверждают сценарий, в котором SPS активность была повышена как в корнях, так и в побегах (дополнительный рисунок 3).
Экспрессия четырех изоформ сахарозосинтазы показала тканевые и температурно-зависимые различия.В то время как изоформы BvSUS1, и BvSUS2 сильно экспрессировались в корнях и их соответствующие белки были в большом количестве, BvSUS3 и BvSUS4 почти не экспрессировались, и их соответствующие белки не обнаруживались с помощью МС в растворимой протеомной фракции ( Рисунок 3E , дополнительный рисунок 4 ). И BvSUS1 , и BvSUS2 были в десять раз ( BvSUS1 ) или стократно ( BvSUS2 ) экспрессироваться в корнях по сравнению с побегами. После периода воздействия холода уровни мРНК обеих изоформ в корнях снизились примерно наполовину. BvSUS2 Уровни транскрипта в побегах увеличились в десять-двадцать раз, однако, не достигнув высоких уровней в стержневых корнях (, фиг. 3E, ). BvSUS2, но не BvSUS1, также снижался на уровне белка, что указывает на дифференциальную динамику обмена белка двух изоформ на холоде (, дополнительная фигура 4).
Для определения клеточного энергетического состояния побегов и стержневых корней были измерены уровни аденилата (рис. 3F) . АТФ, соотношение АТФ / АДФ и энергетический заряд (ЕС = [АТФ] + 0.5 [АДФ] / [АТФ] + [АДФ] + [АМФ]) увеличивалось в побегах всех генотипов. Эту повышенную активность ткани побегов на холоде можно объяснить резким снижением потребления АТФ CO 2 , ассимиляции (Рисунок 2B) и учащением дыхания в побегах (Рисунок 3B) . С другой стороны, энергетика ткани стержневого корня не менялась на холоде. Хотя уровни АТФ также увеличились, отношения АТФ / АДФ в стержневых корнях GT1 и GT2 не изменились или даже уменьшились в GT3.Также EC стержневых корней не увеличивалось на холоде, а скорее уменьшалось в тенденции в GT2 и GT3 стержневых корнях (рис. 3F) . Взятые вместе, эти данные показывают, что развивающиеся стержневые корни на холоде сместились от потребления / хранения сахарозы к ткани, синтезирующей сахарозу, и что у них остались, по крайней мере частично, характеристики поглощающих тканей.
Холодные температуры обращают транслокацию сахарозы и эскулина во флоэму
Приведенные выше данные указывают на то, что вызванное холодом накопление сахара в побегах не или только недостаточно подпитывается ассимиляцией углекислого газа или разложением крахмала, и предполагают, что углерод используется в качестве строительного блока для метаболитов побегов может быть удален из ячеек хранения стержневого корня.Чтобы отследить судьбу углерода на основе стержневого корня после воздействия низких температур, мы напрямую кормили ткань стержневого корня радиоактивно меченной 14 C-сахарозой путем инъекции вещества снаружи в мясистую паренхиматическую ткань стержневого корня растений, выращенных в контрольных условиях 20 ° C. или растения, подвергшиеся воздействию холода (5 дней при 12 ° C, а затем 7 дней при 4 ° C). Затем обработанные растения выдерживали еще одну неделю при контрольных или низких температурах, а затем разрезали на отдельные листья и стержневые корни. Листья или продольные тонкие срезы стержневых корней прессовали и сушили, а включенную радиоактивность визуализировали с использованием фосфорных пластин и программного обеспечения (, рисунок 4, , дополнительный рисунок 6, дополнительный рисунок 7).
Рисунок 4.Распределение 14 C-сахарозы и эскулина в листьях. (A-D) Авторадиография 14 C-сахарозы в листьях. (A) Схематическое изображение эксперимента. Стержневые корни инокулировали раствором 14 C-сахарозы и собирали, а высушенные листья рентгенографировали через неделю. (B) Исходный лист типичного растения, выращенного в течение одной недели при температуре 4 ° C. Почернение жилок указывает на то, что радиоактивность включается и распространяется в ткани листа после инъекции радиоактивно меченной сахарозы в стержневые корни.Сокращения: р = черешок; mv = средняя вена; 1 ° = боковая жилка первого порядка; 2 ° = боковая жилка второго порядка. (C) Исходный лист репрезентативного контрольного растения, выращенного при 20 ° C. (D) радиоактивность в имп / мин (импульсов в минуту), измеренная на изолированных черешках растений, выращенных при температуре 4 или 20 ° C. Центральные линии показывают медианы; рамки указывают 25-й и 75-й процентили; усы в 1,5 раза превышают межквартильный размах от 25-го и 75-го перцентилей, выбросы представлены точками; крестики представляют выборочные средние; n = 16 точек выборки. (E-K) Нагрузки эскулина. Желтая флуоресценция указывает на одревесневшие сосуды ксилемы, синяя флуоресценция указывает на движение эскулина. (E) Схематическое изображение эксперимента. Эскулин наносили на поцарапанную поверхность исходного листа растений, выращенных при 20 ° C. Загруженные растения переносили на 4 ° C или хранили при 20 ° C. Черешки соседних, ненагруженных исходных листьев анализировали на флуоресценцию эскулина у растений при температуре от 4 ° C до 20 ° C. (F-I) Поперечные срезы черешка исходного листа, не загруженного эскулином, от растений, загруженных при 20 ° C. (F, G) Черешки от 20 ° C (F) Изображение в светлом поле. (G) УФ-флуоресцентное изображение. (H, I): Черешки от 4 ° C. (H) Яркое изображение поля. (I) УФ-флуоресцентное изображение. (J, K) Продольные срезы черешка от 4 ° С. J) Изображение в светлом поле. K) УФ-флуоресцентное изображение. Сокращения: xy: ксилема, ph: флоэма. Полосы имеют размер 50 мкм в G и H и 100 мкм в E, F, I и J.
Этот анализ неожиданно показал, что растения, выращенные в условиях 4 ° C, показали распределение радиоактивности в исходных листьях.Радиоактивность в листьях обработанных холодом растений была обнаружена в жилках листа, и интенсивность постепенно снижалась по направлению к верхушке листа, указывая на перенос через сосуды флоэмы ( Рисунок 4B ). Однако у растений, выращиваемых в контрольных условиях, радиоактивность в исходных листьях едва ли можно было обнаружить ( Рисунок 4C ). Однако радиоактивность в некоторой степени обнаруживалась в молодых тонких листьях контрольных растений и выделялась из комбинированных черешков побегов (рис. 4D) . Эта радиоактивность может представлять собой переносимую ксилемой сахарозу или производные из-за повреждения пунктированных сосудов в результате инвазивной процедуры инокуляции.Однако резкая потеря воды в побегах при охлаждении (, рис. 1, ) указывает на то, что при 4 ° C радиоактивно меченная сахароза не эффективно транспортируется к предыдущим исходным листьям через ксилему, а скорее через флоэму.
Чтобы проверить эту гипотезу, мы использовали стратегию, менее инвазивную для органов / тканей, исследованных позже, и более реалистично отражающую фактический транспорт ассимилятов (включая предшествующий «нисходящий» транспорт. Мы загрузили эскулин, мобильный гликозид кумарина из флоэмы (Knoblauch и другие., 2015), распознаваемые несколькими переносчиками сахарозы, в том числе загрузчиком флоэмы Beta vulgaris BvSUT1 (Nieberl et al., 2017), на исходные листья и оценивали маршруты транспорта эскулина непосредственно путем обнаружения флуоресценции, производной от эскулина, в тонких срезах черешков листьев исходного материала. листья тех же растений, которые не были загружены эскулином, после перевода на холод или в контрольные условия. Здесь мы наблюдали, что флуоресценция синего эскулина была обнаружена исключительно во флоэме сосудистых пучков исходных листьев растений, переведенных на холод.Однако флуоресценция не только ограничивалась областью флоэмы, но также обнаруживалась в некоторой небольшой степени в области пучка, перемежающейся желтой флуоресценцией одревесневших сосудов ксилемы (рис. 4) . При 20 ° C флуоресценция эскулина никогда не обнаруживалась во флоэме (, рис. 4, ).
Чтобы проследить поток сахарозы непосредственно от места инокуляции в стержневых корнях, мы выполнили продольные тонкие срезы стержневых корней, инокулированных радиоактивно меченной сахарозой, и экспонировали ткань на фосфорных пластинах для визуализации ( Рисунок 4 , дополнительный рисунок 6, дополнительный рисунок 7) .Радиоактивность в стержневых корнях растений, подвергшихся воздействию 4 ° C, была обнаружена и концентрировалась в прожилках или пятнистых структурах, которые располагались между местом инокуляции и тканью верхушки стержневого корня (кроны). При большем увеличении эти структуры можно было идентифицировать как сосудистые пучки (дополнительный рисунок 6). В стержневых корнях растений, выращенных в контрольных условиях, не наблюдалось такого отчетливого потемнения сосудистых структур, хотя наблюдаемое некоторое почернение ткани кроны указывало на то, что радиоактивность также переносилась вверх в направлении побега (дополнительный рисунок 7).Однако в большинстве случаев радиоактивность корневых корней при 20 ° C была либо ограничена паренхиматозными областями рядом с местом инокуляции, либо концентрировалась в толстых нитях, которые доходили от места инокуляции к появлению боковых корней. Эти результаты показали, что меченые радиоактивным изотопом сахароза и эскулин — последний сначала перемещался к основанию черешка загруженного листа и хотя (по крайней мере, части) стержневого корня — предпочтительно переносились из стержневого корня в побеги на холоде, но не в контрольных условиях. и предположили, что сахароза, высвобождаемая из паренхиматозной запасающей ткани, также транспортируется таким же образом.
Вакуолярные гены и белки импортера и экспортера сахарозы демонстрируют противоположную холодозависимую экспрессию.
Затем мы проанализировали, может ли транспорт сахарозы от стержневых корней к побегам на холоде быть опосредован разной активностью вакуумных импортеров и экспортеров сахарозы. У Arabidopsis импорт и экспорт вакуолярной сахарозы опосредуются активностью транспортеров TST1 и SUC4 соответственно (Schulz et al., 2011; Schneider et al., 2012). У сахарной свеклы гомолог TST1 BvTST2; 1 отвечает за накопление вакуолярной сахарозы (Jung et al., 2015). Экспрессия TST2; 1 в стержневых корнях всех протестированных генотипов значительно превышает таковую в ткани листа, что подтверждает его роль в качестве загрузчика сахарозы в вакуолях паренхимы стержневых корней (, фиг. 5, ). Интересно, что количество как мРНК, так и белка значительно снизилось во всех генотипах в стержневом корне после обработки холодом ( Рисунок 5B , Дополнительный Рисунок 8).
Рисунок 5.Зависимое от холода накопление BvTST2; 1 и BvSUT4 в трех разных генотипах сахарной свеклы. (A) Иллюстрация холодовых процессов. Верхнее изображение: зависимые от холода переходы сахара из стержневых корней в побеги. Среднее изображение: схема процессов и факторов вакуолярного транспорта стержневого корня. Вакуолярная АТФаза (V-H + -АТФаза) устанавливает силу протонного мотива (pmf) через вакуолярную мембрану; TST2; 1 действует как антипортер протона / сахарозы, используя pmf для импорта сахарозы в вакуоли. SUT4 действует как симпортер протон / сахароза, используя pmf для вакуолярного экспорта сахарозы. Нижнее изображение: реципрокная индуцированная холодом регуляция уровней мРНК BvTST2; 1 и BvSUT4 в стержневых корнях (B) Обилие транскриптов мРНК BvTST2; 1 (Bv5_115690_zuju) на основе считывания последовательности РНК.Значения представляют собой средние значения для n = 3 биологических повторов на генотип ± SE. (C) Обилие транскриптов мРНК BvSUT4 (Bv5_124860_zpft.t1) на основе считываний RNA-seq. Значения представляют собой средние значения от n = 3 (мРНК) биологических повторов ± SE. Звездочки указывают на значительные различия между обработками при 20 ° C и 4 ° C согласно t-критерию (* = p <0,05). (D) Субклеточная локализация BvSUT4-GFP в Arabidopsis или Beta vulgaris протопластов листового мезофилла. Единичные оптические секции на всех фотографиях.Зеленым цветом показан GFP-сигнал; автофлуоресценция хлорофилла показана красным. Штанги = 5 мкм. Стрелки указывают в сторону вакуолярной мембраны (тонопласта).
Экспорт сахарозы из вакуоли предположительно опосредуется гомологом семейства SUC4 / SUT4. Мы идентифицировали Bv5_124860_zpft.t1 как однозначного гомолога изоформы SUC4 Arabidopsis и, соответственно, назвали соответствующий переносчик BvSUT4 ( Дополнительная фигура 10 ) . N-концевые слияния кодирующей последовательности BvSUT4 с GFP, временно трансформированной в протопласты мезофилла Beta vulgaris или Arabidopsis, ясно показали, что BvSUT4 был белком, локализованным в тонопласте ( фиг. 5D) .МРНК BvSUT4 показала меньшее количество у старых растений по сравнению с более молодыми (дополнительный рисунок 9). Напротив, мРНК TST2; 1 увеличивалась с прогрессированием развития листа, подтверждая предполагаемую оппозиционную активность транспортных белков TST2; 1 и SUT4 (дополнительная фигура 9). В данных RNA-seq для обработанных холодом генотипов, исследованных в этом исследовании, уровни мРНК SUT4 значительно увеличились в корневых корнях на холоде ( Рисунок 5C ). Эти данные показали, что импорт сахарозы из вакуолярного главного корня был снижен, а высвобождение сахарозы из вакуолярного главного корня увеличивалось в холодных условиях, и предполагали, что противоположная регуляция BvTST2; 1 и BvSUT4 в стержневом корне была основной движущей силой для накопления и доставки сахаров в побеги.
Экспрессия генов регуляторов цветков регулируется в холоде.
Наблюдаемое перемещение сахарозы из стержневых корней в побеги может представлять собой препаративную метаболическую и генетическую перестройку для инициации цветения. Поэтому мы извлекли информацию об экспрессии генов регуляторов цветения и наблюдали значительное подавление репрессора цветков BvFT1 и усиление активатора цветков BvFT2 на холоде в листьях (рис. 6) .Эти результаты согласуются с сообщениями Pin et al. (2010), где лечение холодом также индуцировало FT2 и подавляло экспрессию FT1 (Pin et al., 2012). Анализируемые здесь генотипы имеют двухлетний характер роста, поэтому BTC1 и BBX19 могут не влиять на экспрессию FT1 . Однако эти два гена реципрокно регулировались холодом. В то время как BTC1 был понижен на холоде, BBX19 был активирован. В отличие от результатов Pin et al. (2012), где у яровизированных двухлетних растений уровень мРНК BTC1 и увеличился по сравнению с неяровизированными растениями (Pin et al., 2012), BTC1 был подавлен на холоде. Однако в упомянутом исследовании экспрессия анализировалась после, а не на ранних стадиях яровизации. Мы обнаружили, что BTC1 и BBX19 экспрессировались как в побегах, так и в стержневых корнях, а экспрессия BBX19 в стержневых корнях почти в три раза превышала таковую в побегах при 20 ° C. Однако потенциальные мишени этих кодируемых белков потери функции, FT1 и FT2 , специфически и исключительно экспрессировались в ткани листа (, фиг. 6, ).Таким образом, эти данные показали, что процесс яровизации уже передавался на уровень экспрессии генов регуляторов цветков и что транскрипционные изменения родственных генов действительно происходили как в побегах, так и в стержневых корнях.
Рисунок 6.Экспрессия генов регуляторов цветков. Распространение транскриптов BvBBX19 (Bv9_216430_rwmw.t1), BvBTC1 (Bv2_045920_gycn.t1), BvFT1 (Bv9_214250_miuf.t1) и 250_miuf.t1 на основе Shot2_16417.t1) и 9122_1607BV2 три разных генотипа.Значения представляют собой средние значения для n = 3 биологических повторов ± стандартная ошибка. Звездочки обозначают p -значения <0,05 в соответствии с двусторонним тестом t .
Обсуждение
В этой работе мы обнаружили неизвестный до сих пор переключатель идентичности поглотителя и источника стержневых корней и побегов при воздействии холода на растения сахарной свеклы. В отличие от поглотителей, таких как семена, стебли или клубни, которые принимают идентичность источника после полной дифференциации и последующего отделения от источника питания, переключение между поглотителем и источником у сахарной свеклы происходило в ответ на воздействие окружающей среды, когда ткани побега и стержневого корня все еще оставались физиологическими. связанный.
При 4 ° C ассимиляция CO в побегах 2 резко снизилась, но активность PSII осталась относительно высокой (рис. 2). Эта корреляция указывает на то, что ферменты цикла Кальвина-Бенсона замедляются на холоде и не могут использовать электроны, высвобождаемые из цепи фотосинтетического транспорта электронов (ПЭТ). Во время снижения скорости фиксации CO 2 в холодных условиях высокие скорости ПЭТ могут иметь пагубные последствия, поскольку они производят вредные активные формы кислорода (ROS), такие как супероксид, перекись водорода или гидроксильные анионы (Suzuki and Mittler, 2006; Choudhury et al. ., 2017; Поммеррениг и др., 2018). Во время кинетики воздействия холода ( Рисунок 1 и Рисунок 2 ) мы зафиксировали снижение ассимиляции CO 2 уже при 12 ° C. Как показывает повышенный процент Y (NPQ) (, рис. 2A, ), путь Мелера-аскорбата (Asada, 1999) может действовать как дополнительный гаситель для электронов, высвобождаемых ПЭТ при этой температуре. При 4 ° C этот путь очистки, по-видимому, также замедляется, на что указывает дальнейшее снижение Y (II), но также Y (NPQ) и сопутствующее увеличение Y (NO).Значительное увеличение Y (NO) при 4 ° C указывает на нерегулируемое рассеяние энергии, которое может серьезно повредить мембраны хлоропластов и растительные клетки в зависимости от холода и яркого света. В этих устойчивых сложных условиях холодовая реакция, по-видимому, трансдуцировалась до уровня экспрессии генов, где она приводила к эффективному подавлению транскриптов генов , связанных с фотосинтезом (рис. 2D и 2E) . Индукция генов глутатионредуктазы поддерживает сценарий, в котором листья индуцируют клеточные контрмеры против индуцированного светом переполнения электронов в фотосистемах и повреждений хлоропластов (Рисунок 2E) .
Эти данные согласуются с результатами исследования Arabidopsis, где фотосинтез, а также экспрессия генов RBCS и CAB были значительно снижены после перевода растений, выращенных при 23 ° C, на 5 ° C, хотя фотосинтез восстановился после длительного воздействия. к холоду (Strand et al., 1997). Таким образом, эти метаболические и транскриптомные изменения в конечном итоге приведут к резкому снижению включения CO 2 в сахара, которые необходимы для роста и защиты жизнеспособности клеток на холоде.
Однако, несмотря на инактивацию фотосинтеза, сахара продолжали накапливаться в листьях и уменьшались в стержневых корнях на холоде (Рисунок 1) . Снижение уровней сахарозы в стержневом корне и нарушение дыхания в ткани корня показали, что сахароза не использовалась для энергетического метаболизма во время холода с той же скоростью, что и в контрольных условиях в стержневом корне (рис. 3) . Устойчивые к холоду растения, такие как Arabidopsis, накапливают сахар в листьях на холоде, поддерживая фотосинтетическую активность, снижая нагрузку на флоэму сахарозы и увеличивая импорт сахара в вакуоли листьев (Wingenter et al., 2010; Нэгеле и Хейер, 2013). В то время как Arabidopsis обладает способностью преодолевать сахарную репрессию фотосинтеза после длительного воздействия холода (Huner et al., 1993; Strand et al., 1997), такой механизм, по-видимому, не происходит в сахарной свекле таким же образом. Напротив, резкое снижение фотосинтетической активности побега превратило листья в приемные органы, которые снабжались сахаром из стержневых корней (рис. 4) .
При температурах, не связанных с охлаждением, обратимость оседания стержневого корня и ремобилизация сахаров из хранящих вакуолей могут стать существенными, когда листья должны снова вырасти после повреждения побега, вызванного e.грамм. повреждение корма или когда после зимы образуется новая сильная раковина, такая как соцветие. Однако, на что указывает движение радиоактивно меченой сахарозы и флуоресцентного эскулина к побегам и, следовательно, к предыдущим исходным листьям, также ранняя холодовая реакция вызвала ремобилизацию углеводов из хранилища главного корня (рис. 4) . В то время как биосинтез и гидролиз сахарозы взаимно регулировались в теплых и холодных условиях (рис. 3) , уровни сахарозы главного корня снижались после обработки холодом (, рис. 1, ).В соответствии с этим процессом мы определили противоположное регулирование главного импортера сахарозы вакуолярного (BvTST2; 1) и предполагаемого главного экспортера (BvSUT4) в одной и той же ткани ( Рисунок 5 ). Экспрессия BvTST2; 1 и содержание белка значительно подавлялись, в то время как BvSUT4, напротив, усиливался на холоде. Роль BvSUT4 как экспортера сахарозы подтверждается его общей гомологией с переносчиками сахарозы семейства SUC / SUT и его гомологией с AtSUC4 (, рис. 5, ), для которого была показана как экспортная активность сахарозы, так и локализация в вакуолях ( Schulz et al., 2011; Schneider et al., 2012). Кажется маловероятным, что сахара высвобождаются из вакуолей на холоду в виде моносахаридов через другие переносчики, например уже описанным белком BvIMP (Klemens et al., 2014). Это связано с тем, что вакуолярные инвертазы — предпосылка для образования вакуолярных моносахаридов и, следовательно, экспорта — едва ли активны на анализируемой стадии развития (Giaquinta, 1979; Godt and Roitsch, 2006).
Вышеупомянутые результаты схематично поясняются в следующей модели (Рисунок 7) .Удивительно, что переход потока произошел уже до скрепления, то есть до образования соцветия, которое затем будет действовать как новый поглощающий орган, используя ремобилизованные сахара главного корня в качестве строительных блоков. На ранних этапах яровизации более теплые температуры или более продолжительный световой день, дополнительные предпосылки для установки болтов (Mutasa-Göttgens et al., 2010; Ritz et al., 2010) еще не сигнализируют о наступлении весны. Однако одновременно с изменением идентичности воздействие холода также привело к корректировке уровней экспрессии генов регуляторов цветов. FT1 и FT2 , гены репрессора и активатора цветков (Pin et al., 2010), соответственно, показали реципрокную регуляцию на холоде в побегах (рис. 6) . Экспрессия генов, связанных с цветением, BTC1 и BBX19 в ткани стержневого корня предполагает, что стержневые корни также могут участвовать в восприятии яровизации. Заманчиво задуматься о направлении, в котором недавно было выявлено (Pfeiffer et al., 2014; Broccanello et al., 2015; Tränkner et al., 2017) или еще не обнаруженные локусы закрепления болтов могут содержать еще не охарактеризованные факторы, которые могут объединять как закрепление, так и требуемый переход сток-источник, подобно недавно описанному гомологу FT StSPS6A (‘tuberigen’) у картофеля (Navarro et al., 2011; Abelenda и др., 2019).
Рис. 7.Схематическое изображение перехода от стока к источнику, вызванного холодом. Листовая и стержневая ткань сахарной свеклы перепрограммируются, а идентичности источника и приемника меняются при холоде. Побеги принимают тонкую окраску во время холода.Концентрация биомассы и сахара в побегах увеличивается на (A) , несмотря на снижение фотосинтетической активности и инактивацию ассимиляции углерода (B) . Одновременно дыхание побегов увеличивается на (C) , а пулы клеточного крахмала уменьшаются на (D) . Напротив, стержневые корни показывают снижение уровня сахарозы (E) , но более низкую частоту дыхания (F) , а также повышенный биосинтез сахарозы (G) . Сахар стержневого корня ремобилизируется на холоду из-за противоположной регуляции активности (H) вакуумного импортера сахарозы (BvTST2; 1) и экспортера (BvSUT4) сахарозы.Взятые вместе, это приводит к обращению потока транслокации флоэмы (I) , запускаемому перепрограммированием идентичностей источника и приемника, что может коррелировать с инициированием соцветия.
Наше исследование представляет собой всесторонний анализ ткани стержневого корня сахарной свеклы во время обработки холодом и показывает, что низкие температуры вызывают переход от опускания к источнику, что устанавливает накопление углеводов на основе стержневого корня в побегах. Для этого сахар необходимо загружать во флоэму стержневого корня, транспортировать от стержневого корня к побегам и выгружать в ткани листа.В настоящее время неизвестно, включает ли загрузка флоэмы стержневого корня на холоде стадию апопласта, используются ли одни и те же сосуды флоэмы для перевозки сахара, связанного с корнями и побегами, и как происходит разгрузка сахара в листьях бывшего источника. Последняя проблема, возможно, связана с перепрограммированием активности транспортера, который может опосредовать отток сахара из сосудистой сети в мезофилл, вовлекая как пассивные, так и активные транспортные процессы. Наш транскриптомный и протеомный подход может выявить факторы-кандидаты и переносчики, участвующие в этой разгрузке на холоде в будущем.
Полученные результаты также имеют значение для сельского хозяйства и селекции, где предпринимались попытки выращивать сахарную свеклу в любое время года (Hoffmann and Kluge-Severin, 2011; Hoffmann and Kenter, 2018), сценарий, который станет все более и более реалистичным по мере того, как создание и использование устойчивых к болтованию гибридных генотипов (Pin et al., 2010; Pfeiffer et al., 2014; Tränkner et al., 2016). Кроме того, двухлетнему росту сахарной свеклы может способствовать учащение случаев «теплых» зим, вызванных изменением климата, в e.грамм. среднюю и северную Европу (Lavalle et al., 2009), что позволит выращивать сахарную свеклу при незамерзающих, несмертельных низких температурах.
Однако, даже в незамерзающих, но продолжительных условиях охлаждения выше нуля, преимущества более длительного вегетационного периода будут сведены на нет, по крайней мере, до некоторой степени, из-за описанного здесь компромисса потери сахара главного корня из-за холода. Это явление также может частично объяснять наблюдаемое снижение урожайности и более высокое соотношение выжимок и сахара у растений сахарной свеклы, посеянных осенью или ранней весной (Hoffmann and Kluge-Severin, 2011).
В будущем будет очень ценным проанализировать этот наблюдаемый переход сток-источник стержневых корней у устойчивых к болтованию мутантов без активирующей функции FT2 (Pin et al., 2010), чтобы выявить, требуется ли активность FT для запуска этого перехода. Не менее актуальным будет создание мутантных растений BvSUT4 для изучения влияния отсутствия вакуолярного оттока сахарозы на индукцию цветения и устойчивость к холоду. Такие модифицированные растения, возможно, будут демонстрировать пониженное высвобождение сахарозы из стержневых корней и, следовательно, уменьшенное количество строительных блоков для образования соцветий.Это потенциальное влияние на скрепление болтами делает BvSUT4 весьма актуальной мишенью для подходов к селекции (Pfeiffer et al., 2014; Chiurugwi et al., 2013), нацеленных на сопротивление скреплению болтами и сдерживание вызванной холодом потери сахарозы из основных корней.
Материалы и методы
Растительный материал и условия роста
Для этого исследования использовали три гибридных генотипа сахарной свеклы (GT1, GT2, GT3; KWS SAAT SE, Германия). Растения проращивали и выращивали на стандартном почвенном субстрате ED73 (Einheitserdwerke Patzer, Германия) / 10% (об. / Об.) Смеси песка в режиме 10 часов света / 14 часов темноты, относительной влажности 60% и 110 мкмоль · м -2 с -1 сила света.Для определения кинетики роста и накопления сахара растения выращивали в течение 6 недель при 20 ° C, переносили на 1 неделю при 12 ° C и затем 3 недели при 4 ° C. Для анализа РНК-seq и протеома растения выращивали в течение 10 недель при 20 ° C, переносили на 1 неделю при 12 ° C и затем 2 недели при 4 ° C. Контрольные растения содержали при 20 ° C. Для сбора урожая растения разрезали на ткани побега и стержневого корня. Для каждой ткани было приготовлено 4 пула из трех разных растений. Ткани измельчали кухонным ножом, переносили в жидкий азот и хранили при -80 ° C до дальнейшей обработки.
Измерения флуоресценции хлорофилла
Фотосинтетическую активность измеряли с использованием системы Imaging-PAM M-Series -System (Heinz Walz, Effeltrich, Германия). Растения помещали в темноту на 12 мин для истощения энергии ФСII. Емкость ФСII измеряли путем насыщения 14 циклами световых импульсов PAR 76 (мкмоль фотонов м -2 с -1 ) при 0, 50 и 70 секундах. Записанную флуоресценцию использовали для расчета эффективного квантового выхода ФСII [ Y (II) = (Fm’-F) / Fm ‘], квантового выхода нефотохимического тушения [ Y (NPQ) = 1 — Y (II) ) — 1 / (NPQ + 1 + qL (Fm / Fo-1)) ] и нерегулируемого рассеяния энергии [ Y (NO) = 1 / (NPQ + 1 + qL (Fm / Fo-1)) ].Необходимые коэффициенты рассчитывались по формулам [ NPQ = (Fm-Fm ‘) / Fm’ ], [ qN = (Fm-Fm ‘) / (Fm-Fo’) ], [ Fo ‘= Fo / (Fv / Fm + Fo / Fm ‘) ], [ qP = (Fm’-F) / (Fm’-Fo’) ] и [ qL = (Fm’-F) / (Fm’-Fo ‘) x Fo’ / F = qP x Fo ‘/ F ].
Измерения газообмена
Система GFS-3000 (Heinz Walz, Effeltrich, Германия) использовалась для анализа параметров, связанных с газообменом. Кювету для газообмена 2 2,5 см использовали для измерения скорости ассимиляции СО 2 , дыхания, концентрации СО 2 в листьях и транспирации исходного листа сахарной свеклы.Части листа, включая большие центральные средние ребра, не показаны. Условия внутри кюветы были такими же, как температура, влажность и концентрация CO 2 , при которых росли растения. Последовательность измерений приведена в Таблица 1 . Перечисленные интервалы были определены путем пробного эксперимента, в котором измеряли время, необходимое для стабилизации потока CO 2 после переноса листовой секции в кювету и адаптации к измененной интенсивности света.Измерение было начато после стабилизации потока CO 2 , на что потребовалось около 5 минут. Измерения проводили с 4 растениями в 3-х технических (повторные измерения одного и того же растения) повторах в течение 1 мин для каждого условия, чтобы учесть вариации, вызванные наблюдаемым естественным колебанием листьев и площадью листьев вне кюветы. 30-секундный интервал между измерениями был необходим для того, чтобы лист вернулся к стабилизированному значению.
Таблица 1: Последовательность измерений газообменаДыхание ткани стержневого корня сахарной свеклы
Дыхание стержневого корня измеряли путем вырезания 0.5 см 2 кубиков ткани из центральных областей стержневого корня и измерение выработки CO 2 в кювете для всего растения объемом 60 см 3 . Значения были нормализованы по массе ткани.
ЭкстракцияРНК и секвенирование
РНК выделяли из трех биологических повторов для каждого генотипа, ткани (лист и корень соответственно) и обработки, соответственно. Около 100 мг замороженного растительного материала измельчали в анализаторе тканей (Qiagen, Hilden, Германия) при 30 Гц в течение 90 секунд.После измельчения образцы снова переносили в жидкий N 2 , добавляли 1,5 мл реагента QIAzol Lysis (Qiagen, Hilden, Германия), трижды встряхивали в течение 30 секунд и центрифугировали при 4 ° C в течение 10 минут при 12000 g . Супернатанты переносили в свежие пробирки, инкубировали при комнатной температуре (RT) в течение 5 минут, экстрагировали 300 мкл хлороформа, встряхивали в течение 15 секунд и центрифугировали при 4 ° C в течение 15 минут при 12000 g . Водные супернатанты переносили в свежие пробирки и осаждали РНК 750 мкл изопропанола в течение 10 минут при комнатной температуре и центрифугировали при 4 ° C в течение 10 минут при 12000 g. Осадки промывали 75% EtOH и осадки РНК сушили при 37 ° C в течение 5-10 минут перед ресуспендированием в 100 мкл DEPC-H 2 O осторожным встряхиванием при 37 ° C в течение 5-10 минут. Для удаления остаточных примесей РНК дополнительно очищали с использованием набора RNeasy KIT (Qiagen, Hilden, Германия). К 100 мкл суспензии РНК добавляли 350 мкл буфера RLT (входит в комплект) и кратковременно встряхивали. Затем добавляли 250 мкл этанола и смесь снова встряхивали. РНК очищали на спин-колонке и, наконец, элюировали с колонки до конечного объема 50 мкл (в DEPC-H 2 O) на образец.РНК количественно определяли (NanoDrop 2000 / 2000c, Thermo Fisher) для каждого образца перед дальнейшей обработкой или хранением при -80 ° C. Качество РНК подтверждалось с помощью биоанализатора Agilent Technologies 2100 (Пало-Альто, Калифорния, США). РНК (2 мкг на образец) транскрибировали в кДНК и секвенировали с использованием системы HiSeq 2000 компании Illumina, Inc. Секвенирование и сборка были предоставлены как индивидуальная услуга (GATC GmbH, Констанц, Германия). Процесс статистического анализа включал нормализацию данных, графическое исследование исходных и нормализованных данных, проверку дифференциального выражения для каждой характеристики между условиями и корректировку исходных значений p .Анализ проводился с использованием программного обеспечения R (Team, 2017), пакетов Bioconductor (Gentleman et al., 2004), включая DESeq2 (Anders and Huber, 2010; Love et al., 2014), и пакета SARTools, разработанного в PF2 — Institute Pasteur .
Филогенетический анализ
Множественное выравнивание аминокислотных последовательностей проводили с использованием Clustal Omega (Sievers et al., 2011). Байесовский филогенетический анализ был выполнен с помощью MrBayes версии 3.2 (Ronquist et al., 2012). MrBayes всегда выбирал наиболее подходящие модели «Джонса» (Jones et al., 1992) и «WAG» (Whelan and Goldman, 2001) для анализа аминокислотных замен белков SPS и белков SUS соответственно. MrBayes провел анализ двух параллельных цепей Метрополиса, связанных Монте-Карло Маркова, с четырьмя цепями для 300 000 поколений. Деревья отбирались каждые 1000 поколений. Анализы проводились до тех пор, пока стандартное отклонение разделенных частот не стало ниже 0,005. Деревья консенсуса были рассчитаны после выжигания первых 25% деревьев и визуализированы с помощью FigTree версии 1.4.3.
PCA и анализ тепловой карты
Для данных RNAseq для анализа использовались средние значения cpm. Данные были визуализированы с помощью ClustVis (Metsalu, Vilo, 2015).
Анализ растворимых сахаров и крахмала
Листья и стержневые корни собирали отдельно, замораживали в жидком азоте, сушили вымораживанием и хранили при -80 ° C до использования. Измельченный материал дважды экстрагировали 1 мл 80% EtOH при 80 ° C в течение 1 часа. Объединенные экстракты упаривали в вакуумном концентраторе (Eppendorf, Гамбург, Германия) и гранулы разделяли в ddH 2 O.Для выделения крахмала гранулы промывали 80% EtOH и 1 мл ddH 2 0. 200 мкл воды добавляли к осадку и образец автоклавировали в течение 40 минут при 121 ° C. К осадку добавляли 200 мкл ферментной смеси (5 ед. Α-амилазы; 5 ед. Амилоглюкозидазы в 200 мМ ацетата натрия, pH 4,8) и гидролитически расщепляли крахмал на единицы глюкозы при 37 ° C в течение 4 часов. Ферментативное расщепление останавливали нагреванием образцов до 95 ° C в течение 10 мин. После центрифугирования (20000 г ; 10 мин; 21 ° C) супернатант можно было использовать для количественного определения крахмала.Экстрагированные сахара и гидролитически расщепленный крахмал определяли количественно с использованием NAD + -связанного ферментативного анализа (Stitt et al., 1989).
Анализ фосфорилированных метаболитов
Содержание фосфорилированных промежуточных продуктов (глюкоза-6-фосфат, фруктоза-6-фосфат, сахароза-6-фосфат, UDP-глюкоза, UDP) определяли согласно (Horst et al., 2010) .
Анализ транслокации сахарозы с радиоактивной меткой
Для анализа использовали растения сахарной свеклы в возрасте от 10 до 12 недель, выращенные при 20 ° C в условиях короткого дня (10 часов света, 14 часов темноты).Растения для обработки холодом выращивали еще 1 неделю при 12 ° C, а затем выдерживали от 6 до 7 дней при 4 ° C. Стержневые корни растений с температурой 4 ° C и 20 ° C были частично открыты от окружающего почвенного субстрата, и в верхней половине стержневого корня (примерно на 1 см ниже поверхности почвы) с помощью биопсийной стойки пробивали отверстие диаметром 1 мм. Созданную ямку заполняли 10 мкл 1-2 разбавленной радиоактивно меченной сахарозой (536 мКи / ммоль) (Hartmann Analytic, Брауншвейг, Германия) и покрывали каплей вазелина. Затем растения выдерживали еще 10 дней при 4 ° C или 20 ° C (контроль).В конце обработки все исходные листья инъецированных растений отделяли и индивидуально зажимали между промокательной бумагой. Для обнаружения радиоактивности в стержневых корнях стержневые корни выкапывались, промывались и нарезались тонкими ломтиками (толщиной примерно 0,5 мм) с помощью трюфеля и зажимались между промокательной бумагой. Радиоактивность регистрировали с помощью пластин Phosphor-Image (экспонированных в течение 4-5 часов на адаксиальной поверхности прессованных и высушенных листьев или на высушенные ломтики стержневого корня), и пластины анализировали с помощью Cyclone Storage Phosphor Screen (Packard Bioscience, Мериден, Коннектикут, США).Для количественной оценки радиоактивности черешков исходные черешки листьев тех же листьев, которые использовались для фосфоизображения, были отрезаны, измельчены и измельчены. От 5 до 10 мг порошка смешивали с 2 мл сцинтилляционной смеси и регистрировали количество импульсов в минуту (имп / мин) с помощью жидкостного сцинтилляционного анализатора TRI-Carb 2810TR (Perkin Elmer, Waltham, MA, USA).
In planta транспорт эскулинаДля анализа использовали 10-недельные растения сахарной свеклы, выращенные при 20 ° C в условиях короткого дня (10 часов света, 14 часов темноты).Один исходный лист на растение (обычно на стадии от 10 до 12) шлифовали на адаксиальной стороне мелкой наждачной бумагой (степень 800). Примерно 500 мкл раствора 100 мМ сесквигидрата эскулина (Carl Roth, Карлсруэ, Германия) распределяли по поврежденной поверхности листа с помощью пластиковой пипетки. Обработанные листья покрывали пластиковой пленкой, выдерживали еще 2 дня при 20 ° C, а затем переносили на 4 ° C или выдерживали при 20 ° C (контроль). Через 5-7 дней на холоде листья источника, не нагруженные эскулином, отделяли, и срезы черешков анализировали на флуоресценцию эскулина с помощью конфокального микроскопа Leica TCS SP5II (Leica, Mannheim, Германия) с использованием HCX PL APO lamda blue 20.УФ-объектив 0 × 0,70 IMM. Срезы стержневых корней одних и тех же растений анализировали на флуоресценцию эскулина, чтобы убедиться, что эскулин успешно транслоцировался в стержневые корни как у обработанных холодом, так и у контрольных растений. Ширина полосы излучения составляла 440 — 465 нм для обнаружения флуоресценции эскулина и 594 — 631 нм для флуоресценции лигнина.
Экстракция растворимого белка
Растения собирали, промывали и разделяли на холоде на стержневые корни и исходные листья. Замороженную ткань листа измельчали с помощью N 2 (l), используя мельницу Retsch (Retsch GmbH, Германия).800 мкл буфера E1 (50 мМ HEPES-KOH pH 7,5, 10 мМ MgCl 2 , 1 мМ EDTA pH 7,5, 2 мМ DTT, 1 мМ PMSF, 1 мМ Pefabloc, 5 мМ аминогексановая кислота, 0,1% (об. / v) Triton X-100, 10% (об. / об.) глицерина) переносили в 100 мг измельченной ткани в чашки Эппендорфа на 1,5 мл. Образцы встряхивали и центрифугировали в течение 3 минут при 12 000 g и 4 ° C. 500 мкл супернатанта загружали в колонку с Sephadex NAP5 (G25) (GE Health Care, Великобритания), предварительно уравновешенную буфером E1 без Triton X-100. Элюенты собирали в предварительно охлажденные чашки Eppendorf и хранили при -20 ° C.Ткани стержневого корня обрабатывали, как указано выше, со следующими изменениями: стержневой корень смешивали с буфером E1 при 4 ° C до получения гомогенной пульпы. Мякоть грубо фильтровали через кухонное сито и центрифугировали. 5 мл супернатанта диализовали через мембрану с размером пор 12 кДа в течение 48 часов против 2 л ddH 2 О. Воду заменяли семь-восемь раз. Образцы собирали в предварительно охлажденные чашки Eppendorf и использовали для ферментативных тестов или хранили при -20 ° C. Жидкостную хроматографию и тандемную масс-спектрометрию выполняли, как описано в (Jung et al., 2015).
Выделение вакуолей стержневого корня и вакуолярных белков
Вакуоли выделяли, как описано (Jung et al., 2015).
Анализ фосфат-синтазы сахарозы
80 мкг растворимого белка добавляли к 200 мкл свежеприготовленного E max (50 мМ HEPES-KOH pH 7,5, 20 мМ KCl, 4 мМ MgCl 2 , 12 мМ UDP-Glc, 10 мМ Frc-6-P: Glc-6-P (1: 4)), E lim (50 мМ HEPES-KOH pH 7,5, 20 мМ KCl, 4 мМ MgCl 2 , 4 мМ UDP-Glc, 2 мМ Frc-6-P: Glc-6-P (1: 4), 5 мМ KH 2 PO 4 ) и E пустой (= E max без UDP-глюкозы и сахар-фосфатов) , соответственно.Образцы инкубировали в течение 20 минут при 25 ° C, затем 5 минут при 95 ° C для остановки реакции и центрифугировали при 12000 g при 4 ° C в течение 5 минут. 100 мкл супернатанта вносили пипеткой в 100 мкл 5 М КОН и инкубировали 10 мин при 95 ° C. Раствор смешивали с 800 мкл антрона (14,6 M H 2 SO 4 , 0,14% (мас. / Об.) Антрон) и сразу же измеряли поглощение при 620 нм. Калибровочный стандарт был сделан с 0-5 ммоль сахарозы.
Субклеточная локализация BvSUT4 в протопластах мезофилла Arabidopsis и сахарной свеклы
CDS BvSUT4 (Bv5_124860_zpft.t1 = BVRB_5g124860) была амплифицирована из РНК листа B. vulgaris с специфичными для генов праймерами BvSUT4-CACC-f (5′-CAC CAT GAC AGG CCA GGA CCA AAA TA-3 ‘) и BvSUT4-rev (5’-TAC ATG CAT CAC ATG AAC TCT GG-3 ‘). Полученная открытая рамка считывания была клонирована в pENTR / D-TOPO (Life Technologies, Дармштадт, Германия), секвенирована и рекомбинирована в совместимый со шлюзом целевой вектор pK7FWG, 0 (Karimi et al., 2002) для получения ap 35S :: BvSUT4-GFP сплав. Переходное преобразование А.thaliana протопластов мезофилла выполняли, как описано (Abel and Theologis, 1994). Выделение и временную трансформацию протопластов мезофилла B. vulgaris выполняли, как описано (Nieberl et al., 2017).
Доступность данных
Данные о секвенировании транскриптомов были депонированы в архиве чтения последовательностей GenBank в BioProject PRJNA602804.
Финансирование
Эта работа финансировалась за счет исследовательского гранта, выделенного HEN и США Федеральным министерством образования и исследований (проект BMBF «Betahiemis», FKZ 031B0185).
Вклад авторов
H.E.N., F.L., W.K., K.H., U.S., B.P., разработали исследование;
C.M.R., C.M., I.K., W.Z., F.R., P.N., B.P. провели исследование;
O.C., J.M.C.G, T.M. внесены новые аналитические / вычислительные / и т. д. инструменты;
C.M.R., C.M., B.P., проанализированные данные;
B.P., C.M. и H.E.N. написал газету.
Благодарности
Авторы хотели бы поблагодарить
Микаэлу Брок, Дэвида Пшайдта (оба FAU Эрланген-Нюрнберг), Тима Сейбеля (Университет Кайзерслаутерна) за отличную техническую помощь и Карин Фидлер (KWS SAAT SE) за предоставление Beta. vulgaris посевной материал и выращивание сахарной свеклы.
Сноски
Краткое изложение одним предложением: Обработка холодом преобразует стержневые корни сахарной свеклы ( Beta vulgaris ) из органов-поглотителей, хранящих сахарозу, в органы-источники, мобилизующие сахарозу, до закрепления.
Автор , ответственный за распространение материалов, составляющих выводы, представленные в этой статье, в соответствии с политикой, описанной в инструкциях для авторов (www.plantcell.org): Бенджамин Поммеррениг (pommerre {at} bio.uni-kl.de).
Ссылки
- ↵
- ↵
- ↵
- ↵
- ↵
Asada, K., Endo, T., Mano, J., and Miyake, C. (1998). Молекулярные механизмы релаксации и защиты от легкого стресса. В «Реакции фотосинтезирующих организмов на стресс» (ред. К. Сатон, Н. Мурата), стр. 37–52 (Elsevier: Amsterdam).
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵ ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
Ститт, М.


 Одна из главных достопримечательностей — церковь, построенная монахами внутри меловой скалы;
Одна из главных достопримечательностей — церковь, построенная монахами внутри меловой скалы;